
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
3.4. Газовые законы
Газы отличаются от веществ, находящихся в твердом и жидком агрегатном состояниях, тем, что способны занимать весь предоставленный им объем. Эта особенность газов находит отражение в ряде специфических законов, называемых газовыми.
Состояние идеального газа заданной массы характеризуется тремя параметрами: давлением p, объемом V и температурой T. Между этими величинами экспериментально установлены следую-щие соотношения:
1. Закон Бойля-Мариотта.
При постоянной температуре (T = const) p1V1 = p2V2 или pV = const.
2. Закон Гей-Люссака.
При
постоянном давлении (p
= const)
 или
или
 .
.
3. Закон Шарля.
При
постоянном объеме (V
= const)
 или
или
 .
.
Эти три закона можно объединить в один универсальный газовый закон:
|
(5) |
4. Закон Авогадро.
В равных объемах газов при одинаковых условиях (p,T = const) содержится одинаковое число молекул газа.
Из закона вытекают два очень важных следствия:
1) При p,T = const в равных объемах любых газов содержится одинаковое число молекул и, следовательно, одинаковое количество газов.
Действительно, если V(X) = V(Y), то N(X) = N(Y) и согласно формуле (4) n(X) = n(Y).
2) Объем, занимаемый одним молем газа, при определенных условиях (p и T), есть величина постоянная.
Объем одного моль газа при определенных условиях называется его молярным объемом и обозначается Vm.
При нормальных условиях (сокращенно н.у.), то есть при p = 1 атм = 760 мм рт ст = 101325 Па и T = 00С = 273 K, 1 моль любого газа занимает объем, равный 22,4 л. Иными словами, при н.у. молярный объем газа равен 22,4 л/моль.
Таким образом, при н.у. количество газа можно рассчитать по формуле:
|
(6) |
Из закона Авогадро также следует закон объемных отношений:
Объемы вступающих в реакцию газов относятся друг к другу как стехиометрические коэффициенты в уравнении реакции.
Основным уравнением в теории газов, которое связывает p,V и T, является уравнение Менделеева-Клапейрона:
|
(7) |
где R универсальная газовая постоянная, равная 8,31 Дж/(мольK) (в единицах СИ: давление (Па), объем (м3)) или 0,082 латм/(мольK) (во внесистемных единицах: давление (атм), объем (л)).
Пример 1. При температуре 170С и давлении 104 кПа газ занимает объем 380 мл. Найти количество газа.
Решение.
Приведем объем газа к нормальным условиям. Из формулы (5):

Количество газа найдем по формуле (6):

Эту задачу также можно решить с помощью уравнения Менделеева-Клапейрона (7). Переведя все используемые единицы в систему Си (1 мл = 10–6 м3; 1 кПа = 103 Па) и учитывая, что [Дж] = [Па][м3], получим:
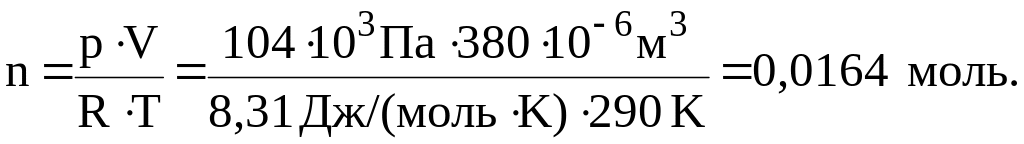
Пример 2. Вычислить давление в баллоне емкостью 20 л, содержащем при 270С 160 г кислорода.
Решение.
Используя уравнение (7), получим:

Пример 3. 10 л водорода сожгли в избытке кислорода. Найти объем прореагировавшего кислорода и объем образовавшихся водяных паров.
Решение.
Запишем уравнение реакции:
2H2 (газ) + O2 (газ) = 2H2O (пар)
Из закона объемных отношений следует:
V(H2O) = V(H2) = 10 л;
V(O2)
=
![]() V(H2)
=
10
= 5 л.
V(H2)
=
10
= 5 л.
Пример 4. Найти объем водорода (при н.у.), который выделится при растворении 6,5 г цинка в избытке соляной кислоты.
Решение.
Запишем уравнение реакции:
Zn + 2HCl = ZnCl2 + H2↑
Согласно закону стехиометрических соотношений:
![]()
Объем водорода при н.у. найдем по уравнению (6):
![]()
Задание для самостоятельной работы
1. Найти объем, который займет аммиак массой 34 г при температуре 1000С и давлении 1 МПа.
2. При температуре 270С и давлении 720 мм рт ст объем газа равен 5 л. Найти объем, который займет это же количество газа при температуре 390С и давлении 104 кПа.
3. Найти объем оксида углерода (IV) при н.у., который выделится при термическом разложении 20 г карбоната кальция.
4. Определить объем кислорода, необходимый для сжигания 20,5 л бутана, измеренного при температуре 470С и давлении 4 атм.
5. К 100 мл смеси этана с азотом прибавили 200 мл кислорода. После сгорания этана объем смеси составил 175 мл. Определить объемный состав исходной газовой смеси.

 или
или
 .
.
