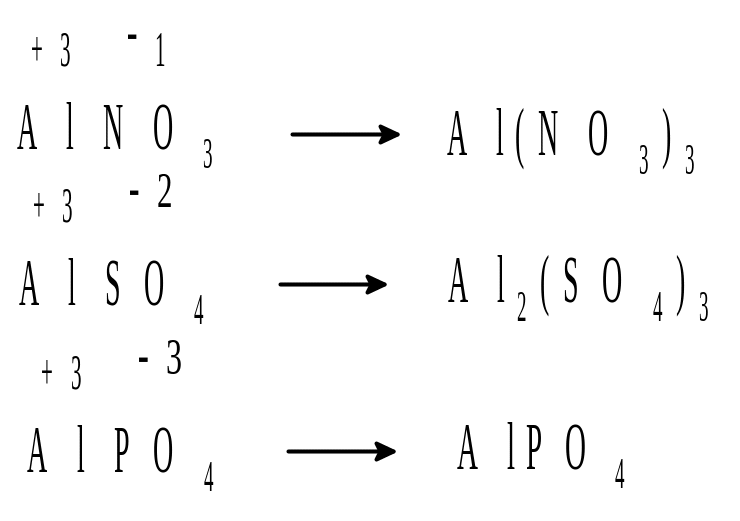- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Глава 1. Основные понятия химии
Все вещества состоят из молекул.
Молекула мельчайшая частица вещества, сохраняющая его химические свойства.
Молекулы состоят из атомов.
Атом мельчайшая частица химического элемента.
Атом состоит из ядра и электронных оболочек. Ядро, в свою очередь, состоит из нейтронов и протонов. Заряд ядра равен числу протонов.
Химический элемент это вид атомов с определенным зарядом ядра.
Каждый химический элемент обозначается определенным символом: H водород, O кислород, S сера, Cl хлор и т.д.
Символ элемента обозначает один его атом.
Чтобы обозначить несколько атомов одного и того же элемента перед символом элемента ставится коэффициент:
2O два атома кислорода, 5S пять атомов серы и т.д.
Состав химических соединений обозначается при помощи химических формул, которые состоят из символов элементов и подстрочных индексов.
Молекула может содержать атомы одного и того же элемента, в таком случае вещество называется простым. Молекулы простых веществ могут быть одноатомными как, например, He или Ar, а могут состоять из двух (О2, H2 и др.) или нескольких (О3, P4, S8 и др.) атомов.
Если в молекуле содержатся атомы разных элементов, то вещество называется сложным, например Н2SO4. Данная формула отражает молекулу сложного вещества, в которой содержатся два атома водорода, один атом серы и четыре атома кислорода.
Количество атомов каждого элемента в молекуле простого или сложного вещества определяет индекс.

Если индекс равен «1», то он не записывается.
1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
Химические формулы веществ составляются в соответствии с валентностью элементов.
Валентность это свойство атомов одного элемента присоединять или замещать определенное число атомов другого элемента.
Существуют элементы с постоянной и переменной валентностью.
К элементам с постоянной валентностью относятся:
-
Элементы
Валентность
H, Li, Na, K, Rb, Cs, Fr, Ag, F
I
O, Be, Mg, Ca, Sr, Ba, Zn, Cd
II
B, Al
III
Все остальные могут иметь переменную валентность. Например:
-
Элементы
Валентность
Fe
II, III, VI
Cl
I, III, V, VII
Валентность знака не имеет.
Для составления формул соединений, состоящих из атомов двух элементов над символами элементов записывается их валентность, затем записываются индексы:

Если индексы одинаковы они сокращаются.
Для составления формул более сложных соединений удобнее пользоваться понятием степени окисления.
Степенью окисления называют условный заряд атома в молекуле, вычисленный из предположения, что она состоит только из ионов.
Степень окисления элемента в простых веществах принимается равной нулю.
Атомы некоторых элементов имеют постоянные значения степени окисления. К ним относятся:
Элемент |
Степень окисления |
F |
1 |
Li, Na, K, Rb, Cs |
+1 |
Be, Mg, Ca, Sr, Ba, Zn, Cd |
+2 |
Al, Ga |
+3 |
Остальные элементы имеют переменную степень окисления.
Так, атом водорода имеет степень окисления +1, за исключением соединений с металлами (гидридов), в которых степень окисления водорода равна 1 (NaH1, CaH21).
В большинстве случаев степень окисления атома кислорода равна 2. Исключения составляют пероксиды (H2O2, Na2O2), в которых степень окисления кислорода равна 1, и OF2, где кислород проявляет степень окисления +2.
Для всех остальных атомов степень окисления вычисляют, исходя из того, суммарный заряд атомов в молекуле равен нулю.
Пример 1. Вычислить степень окисления атома азота в молекуле HNO3.
Решение.
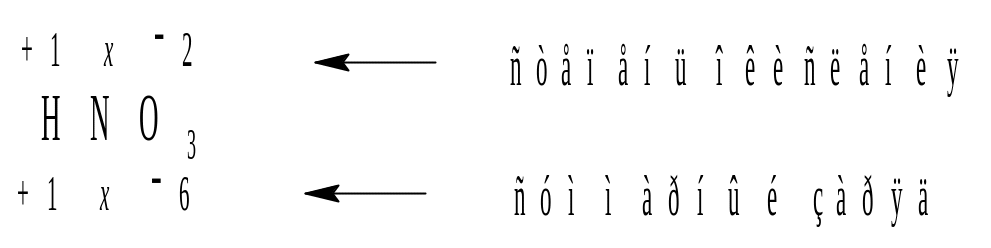
Тогда: +1 + x + (2)3 = 0.
Отсюда: x = 5 и степень окисления атома азота равна +5.
Пример 2. Вычислить степень окисления хрома в Nа2Сr2О7.
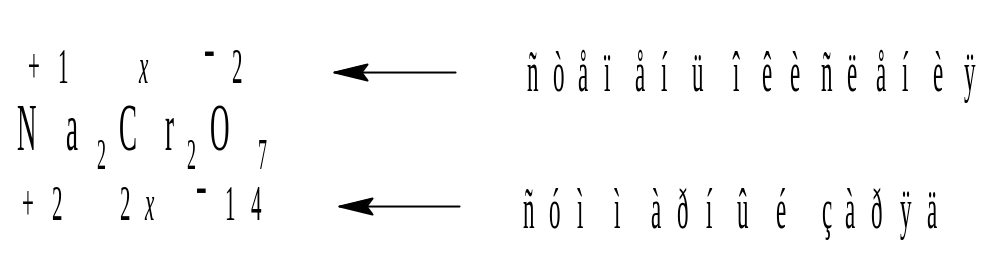
Тогда: (+1)2 + x2 + (2)7 = 0.
Отсюда: x = 6 и степень окисления атома хрома равна +6.
Пользуясь понятием степени окисления можно определить условный заряд не только отдельного атома в молекуле, но и группы атомов.
Например, в молекуле HNO3 степень окисления атома водорода равна +1, тогда группа атомов NO3 имеет заряд 1, так как сумма зарядов в молекуле должна быть равна 0.
Аналогично, в молекуле H2SO4 группа атомов SO4 имеет заряд 2, а в молекуле H3PO4 заряд группы PO4 равен 3.
Используя это соотношение, можно легко составлять формулы сложных веществ.
Пример 3. Составить формулы нитрата, сульфата и фосфата алюминия.
Решение.