
- •Часть 2. Теплота и молекулярная физика
- •Термодинамика и молекулярная физика Литература
- •Глава 1. Термодинамика §1. Основные понятия. Первый закон термодинамики
- •§2. Термодинамическая модель идеального газа. Теплоемкость
- •§3. Равновесные процессы
- •§4. Круговые процессы (циклы). Кпд цикла Карно
- •§5. Тепловые и холодильные машины. Энтропия. Второй закон термодинамики
- •§7. Основное уравнение кинетической теории газов
- •§8. Классическая теория теплоемкости газов
- •§9. Распределение молекул газа по скоростям. Функция распределения Максвелла
- •§10. Газ в поле силы тяжести. Распределение Больцмана. Газовые оболочки небесных тел
- •§11. Средняя длина свободного пробега молекул газа. Явления переноса
- •§12. Статистический смысл второго закона термодинамики.
- •Глава 3. Реальные газы §13. Уравнение Ван-дер-Ваальса
- •§14. Исследование уравнения Ван-дер-Ваальса. Критическое состояние в-ва
- •§15. Эффект Джоуля-Томсона.
- •Глава 4. Жидкости §16. Объемные свойства жидкостей
- •§ 17. Поверхностные свойства жидкостей
- •§18. Давление Лапласа. Капиллярные явления
- •§19. Жидкие растворы
- •Глава 5. Твердые тела §20. Кристаллическая структура твердых тел
- •§21. Тепловые свойства кристаллов
- •§22. Твердые полимеры
- •Глава 6. Фазовые переходы §23. Агрегатные состояния и фазы. Уравнение Клапейрона-Клаузиуса
- •§24. Испарение и конденсация
- •§25. Давление насыщенных паров над искривленной поверхностью жидкости
- •§26. Плавление и отвердевание
- •§27. Фазовые переходы в растворах
- •Оглавление
§3. Равновесные процессы
1. Термодинамическое равновесие – это такое состояние термодинамической системы, когда температура T и давление p во всех точках системы одинаковы. При термодинамическом равновесии всякие макроскопические изменения прекращаются.
2. В равновесном процессе система проходит через последовательность равновесных состояний. Равновесным может быть только бесконечно медленный процесс, поэтому он является идеальной моделью медленно протекающих реальных процессов. В настоящем курсе рассматриваются только равновесные процессы.
Равновесными могут быть не только термодинамические, но и механические процессы. Так, при вычислении работы подъема тел в поле силы тяжести в общем случае молчаливо предполагается, что тело поднимается бесконечно медленно, ускорение подъема равно нулю, сила тяги равна по величине силе тяжести mg, поэтому работа подъема A = mgh.
3 . Работа
идеального газа в изопроцессах
. Работа
идеального газа в изопроцессах
а. Изотермический процесс, T = const. Пусть идеальный газ, взятый в количестве молей, расширяется от объема V1 до объема V2 при постоянной температуре. Вычислим работу, совершаемую газом. Для этого в формулу dA = pdV подставим p из уравнения Клапейрона-Менделеева и проинтегрируем.
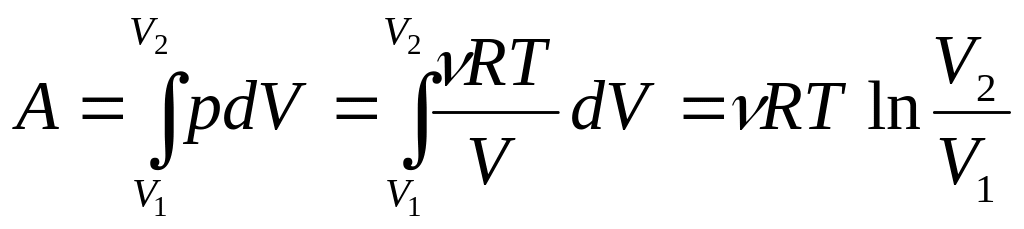 .
(3.1)
.
(3.1)
Если газ расширяется (рис.5), объем увеличивается, V2 > V1, работа положительна, A > 0. На графике эта работа соответствует площади фигуры в пределах от V1 до V2 под кривой процесса.
Е сли
газ сжимается (работу совершают внешние
тела), V2 < V1,
работа отрицательна, A < 0.
При расширении к газу должно подводиться
тепло, при сжатии – отводиться.
сли
газ сжимается (работу совершают внешние
тела), V2 < V1,
работа отрицательна, A < 0.
При расширении к газу должно подводиться
тепло, при сжатии – отводиться.
б. Изобарический процесс, p = const. В системе координат p, V графиком изобарического процесса является прямая линия, параллельная оси абсцисс (рис.6). Поскольку давление постоянно, вычисление работы расширения газа упрощается.
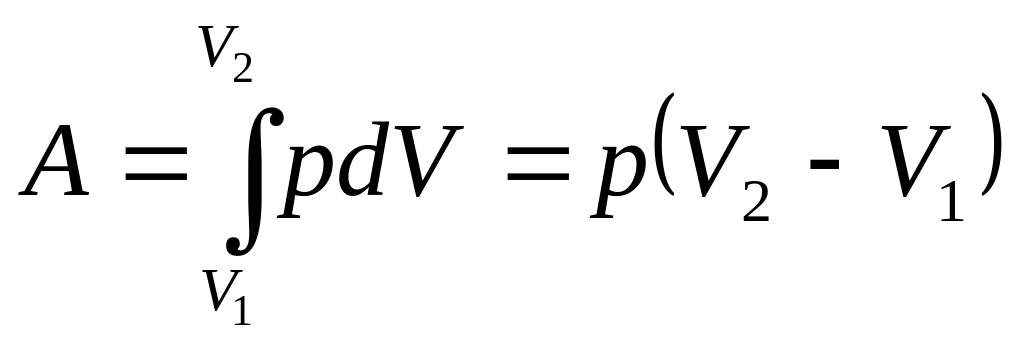 .
(3.2)
.
(3.2)
Чтобы газ расширялся при постоянном давлении, к нему нужно подводить тепло. Если газ сжимается внешними телами, то для поддержания давления постоянным от газа должно отводиться тепло.
в . Изохорический
процесс, V = const.
В системе координат p, V
графиком изохоры является прямая линия,
параллельная оси ординат (рис.7). Объем
системы не меняется, работа равна нулю,
A = 0.
При повышении давления к системе
подводится тепло, при понижении –
отводится.
. Изохорический
процесс, V = const.
В системе координат p, V
графиком изохоры является прямая линия,
параллельная оси ординат (рис.7). Объем
системы не меняется, работа равна нулю,
A = 0.
При повышении давления к системе
подводится тепло, при понижении –
отводится.
4. Адиабатный процесс. Наряду с изотермическим, изобарическим, изохорическим процессами, протекающими с теплообменом между системой и окружающей средой, в природе реализуются процессы, протекающие без теплообмена. Обычно это быстрые процессы, когда теплообмен просто не успевает произойти. В этом случае dQ = 0. (Например, распространение звуковых волн). Но можно реализовать и медленный процесс с dQ = 0, если поместить систему в теплоизолирующую оболочку. Такие оболочки называются адиабатными (от греч. a – не, diabatos – проходимый, непроходимая для тепла). Адиабатный процесс также является изопроцессом, поскольку остается неизменной теплоемкость системы, C = dQ dT = 0 = const.
Найдем уравнение адиабатного процесса для идеального газа. Будем исходить из 1-го закона термодинамики, который здесь принимает вид: 0 = dU + pdV. (3.3)
Так как dU = CV dT, то 0 = dU = CV dT + pdV. (3.4)
В
уравнение входит 3 параметра: p, V
и T. Сведем это число к двум, выразив
T из уравнения Клапейрона-Менделеева.
![]() ,
,
![]() .
Подставляем, записав нуль как обычно
справа.
.
Подставляем, записав нуль как обычно
справа.
![]() .
(3.5)
.
(3.5)
Из уравнения Майера R = Cp CV. Подставив и избавившись от дробности, получаем:
![]() .
(3.6)
.
(3.6)
Разделив
все члены на pVCV
и обозначив Cp CV = ,
получаем дифференциальное уравнение
адиабатного процесса в переменных p
и V:
![]() .
(3.7)
.
(3.7)
Интегрируем. pV = const. Симеон Пуассон, 1823 (3.8)
Выразив
давление p из уравнения
Клапейрона-Менделеева получаем уравнение
Пуассона в переменных T и V:
![]() ,
или TV 1 = const.
(3.9)
,
или TV 1 = const.
(3.9)
Если из уравнения Клапейрона-Менделеева выразить объем V, получаем уравнение адиабаты в параметрах p, T: p(RT/p) = const, или p1 T = const. (3.10)
Н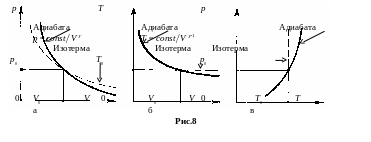 а
рис.8 показаны графики адиабаты в
сравнении с изотермой в координатах p,
V (рис.8-а), в координатах
T, V (рис.8-б), в
координатах p, T (рис.8-в).
а
рис.8 показаны графики адиабаты в
сравнении с изотермой в координатах p,
V (рис.8-а), в координатах
T, V (рис.8-б), в
координатах p, T (рис.8-в).
5. Работа
идеального газа в адиабатном процессе.
Вычислим работу в параметрах p, V.
Для этого в общее выражение работы
(формула (2.16)) подставим p из уравнения
Пуассона, p = const V .
 .
(3.11)
.
(3.11)
После
интегрирования получаем:
![]() .
(3.12)
.
(3.12)
Значение
константы можно выразить через любое
состояние системы. Например, через
начальное, p1V1 = const.
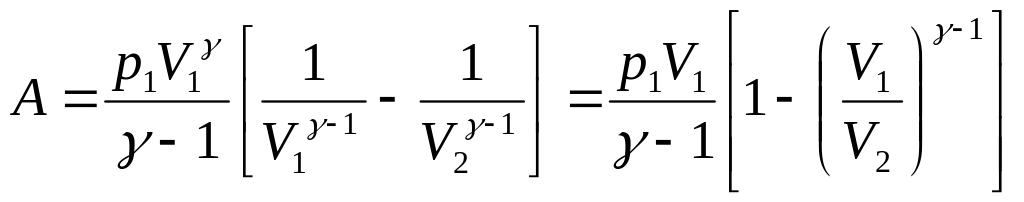 .
(3.13)
.
(3.13)
Это работа идеального газа в адиабатном процессе в параметрах p, V.
Если
записать уравнение адиабаты в параметрах
T, V (формула 3.9) для начального и
конечного состояний системы,
![]() ,
то (V1 V2)1=T2 T1,
а p1V1 = RT1.
,
то (V1 V2)1=T2 T1,
а p1V1 = RT1.
Подставляем в (3.13).
![]() .
(3.14)
.
(3.14)
Аналогично
получим в параметрах p и T.
![]() .
(3.15)
.
(3.15)
6. Уравнение
Бернулли для идеального газа.
Термодинамическая система может
представлять собой не только неподвижный,
но и движущийся идеальный газ. В случае
медленного движения идеального сжимаемого
газа к трем энергиям единичного объема,
которые входят в уравнение Д.Бернулли
для идеальной несжимаемой жидкости,
добавляется еще внутренняя энергия.
Поэтому закон сохранения энергии для
линии тока идеального газа принимает
вид:
![]() .
(3.16)
.
(3.16)
Здесь u = U V – внутренняя энергия единичного объема. Очевидно, U = CVT = cV mT. Если выразить давление p из уравнения Клапейрона-Менделеева, p = RT/V = RT/M, выразить из уравнения (2.24) R = Cp CV и подставить, то первые два члена объединяются.
![]() .
(3.17)
.
(3.17)
Тогда
![]() .
(3.18)
.
(3.18)
Подставляем в (3.17) и сокращаем на .
![]() . Уравнение
Бернулли для идеального газа (3.19)
. Уравнение
Бернулли для идеального газа (3.19)
7. Скорость истечения идеального газа из баллона через малое отверстие. Ее вычисление имеет большое значение в технике реактивного движения и в космонавтике.
Пусть в баллоне при температуре T1 и под давлением p1 находится идеальный газ. Полагаем, что в стенке баллона имеется малое отверстие, через которое газ вытекает в горизонтальном направлении. Допущение о горизонтальности струи позволяет избавиться в уравнении Бернулли от члена gh, что не существенно для результата, но упрощает решение.
В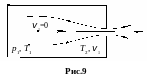 ыберем
на горизонтальной линии тока, проходящей
через отверстие, в глубине баллона, где
течение мало заметно, точку 1, где линейную
скорость v1
можно принять равной нулю, v1 = 0,
и точку 2 в сечении отверстия (рис.9).
ыберем
на горизонтальной линии тока, проходящей
через отверстие, в глубине баллона, где
течение мало заметно, точку 1, где линейную
скорость v1
можно принять равной нулю, v1 = 0,
и точку 2 в сечении отверстия (рис.9).
При этих условиях уравнение Бернулли для линии тока принимает вид:
![]() .
(3.20)
.
(3.20)
Отсюда
выражаем скорость истечения газа
![]() .
(3.21)
.
(3.21)
Если
полагать процесс истечения адиабатным,
что в большинстве случаев справедливо,
то от температурного скачка T1 T2,
который трудно оценить, можно перейти
к скачку давлений. Из формулы (3.10)
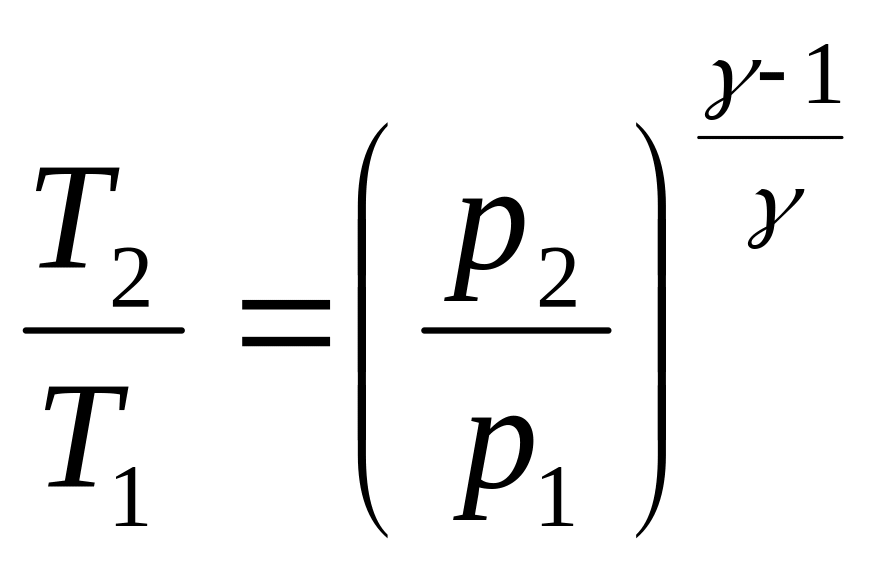 ,
,
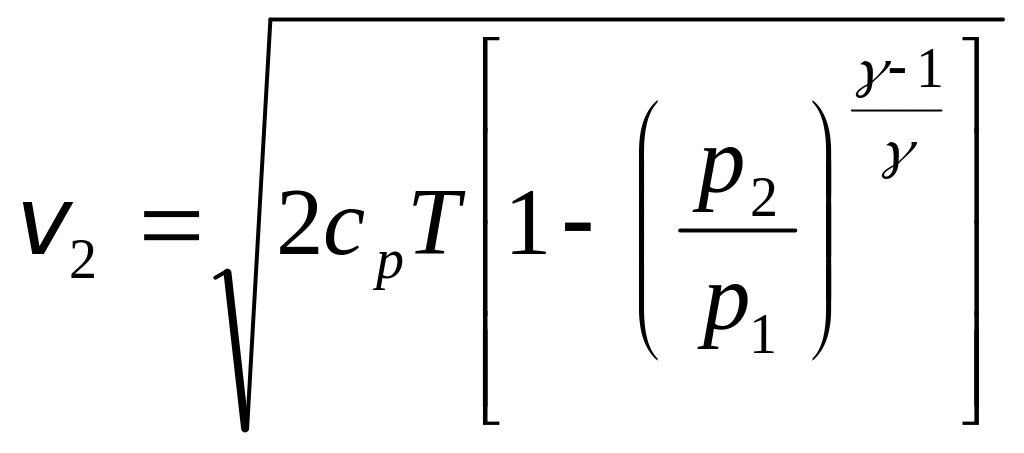 .
(3.22)
.
(3.22)
Скорость максимальна
при истечении в пустоту при p2 = 0
![]() .
(3.23)
.
(3.23)
Чем
меньше молярная масса газа M, тем
больше скорость его истечения. Для
молекул воды, образующихся в
водородно-кислородном двигателе,
скорость истечения при T1 = 1500 K
и при условии, что Cp = 4R,
составляет
![]() .
.
