
- •Часть 2. Теплота и молекулярная физика
- •Термодинамика и молекулярная физика Литература
- •Глава 1. Термодинамика §1. Основные понятия. Первый закон термодинамики
- •§2. Термодинамическая модель идеального газа. Теплоемкость
- •§3. Равновесные процессы
- •§4. Круговые процессы (циклы). Кпд цикла Карно
- •§5. Тепловые и холодильные машины. Энтропия. Второй закон термодинамики
- •§7. Основное уравнение кинетической теории газов
- •§8. Классическая теория теплоемкости газов
- •§9. Распределение молекул газа по скоростям. Функция распределения Максвелла
- •§10. Газ в поле силы тяжести. Распределение Больцмана. Газовые оболочки небесных тел
- •§11. Средняя длина свободного пробега молекул газа. Явления переноса
- •§12. Статистический смысл второго закона термодинамики.
- •Глава 3. Реальные газы §13. Уравнение Ван-дер-Ваальса
- •§14. Исследование уравнения Ван-дер-Ваальса. Критическое состояние в-ва
- •§15. Эффект Джоуля-Томсона.
- •Глава 4. Жидкости §16. Объемные свойства жидкостей
- •§ 17. Поверхностные свойства жидкостей
- •§18. Давление Лапласа. Капиллярные явления
- •§19. Жидкие растворы
- •Глава 5. Твердые тела §20. Кристаллическая структура твердых тел
- •§21. Тепловые свойства кристаллов
- •§22. Твердые полимеры
- •Глава 6. Фазовые переходы §23. Агрегатные состояния и фазы. Уравнение Клапейрона-Клаузиуса
- •§24. Испарение и конденсация
- •§25. Давление насыщенных паров над искривленной поверхностью жидкости
- •§26. Плавление и отвердевание
- •§27. Фазовые переходы в растворах
- •Оглавление
Глава 5. Твердые тела §20. Кристаллическая структура твердых тел
1. Кристаллические и аморфные тела. Твердые тела сохраняют объем и форму. По своей внутренней структуре они делятся на кристаллические и аморфные. Тела с регулярным расположением атомов или молекул, называют кристаллическими. В кристаллах существует дальний порядок.
В аморфных телах молекулы расположены примерно так же, как и в жидкостях. В этом смысле аморфные тела называют переохлажденными жидкостями. В них существует ближний порядок.
Свойства кристаллических тел определяются не только свойствами атомов и молекул, образующих кристалл, но также их расположением. Благодаря их регулярной структуре кристаллы анизотропны. Их физические свойства зависят еще и от направления в кристалле.
2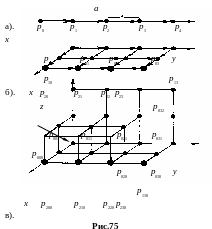 . Трансляции.
Как показал в 1848 г. француз Браве,
прерывная периодическая структура
кристалла с геометрической точки зрения
может быть осуществлена параллельным
переносом (трансляцией) определенной
комбинации частиц. Различают одномерную,
двумерную и трехмерную трансляцию.
. Трансляции.
Как показал в 1848 г. француз Браве,
прерывная периодическая структура
кристалла с геометрической точки зрения
может быть осуществлена параллельным
переносом (трансляцией) определенной
комбинации частиц. Различают одномерную,
двумерную и трехмерную трансляцию.
Одномерная (линейная) трансляция. Положение точки p определяется вектором трансляции,
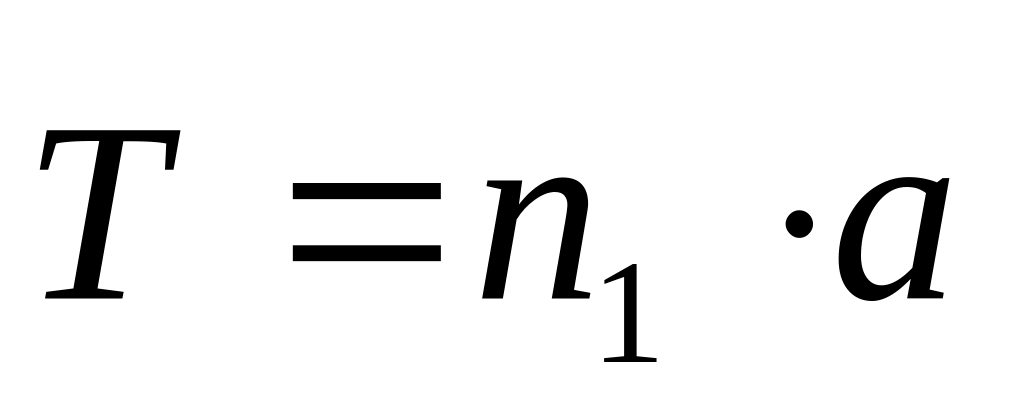 ,
где a – период
трансляции, n1= 0,
1, 2 3, …– целое число (рис.75а).
,
где a – период
трансляции, n1= 0,
1, 2 3, …– целое число (рис.75а).
б. Двумерная
(плоская) трансляция. Положение точки
в этом случае определяется вектором
трансляции
![]() ,
где a и b
– периоды трансляции в соответствующих
направлениях, а n1
и n2
– целые числа (рис.75-б).
,
где a и b
– периоды трансляции в соответствующих
направлениях, а n1
и n2
– целые числа (рис.75-б).
в. Трехмерная
трансляция формирует пространственную
решетку. Положение любой точки в ней
определяется вектором трансляции
![]() (рис.75-в).
(рис.75-в).
Применительно к реальным кристаллам точки p называются узлами кристаллической решетки.
3. Решетка
Браве. Комбинация из минимальных
векторов
![]() ,
,
![]() и
и
![]() ,
с помощью которой реализуется сколь
угодно протяженный кристалл, называется
базисом решетки. Параллелепипед с
ребрами a, b,
c называется основным
(базисным) параллелепипедом или решеткой
Браве. Вместе с атомами, которые в нем
находятся, параллелепипед Браве (решетка
Браве) образует элементарную ячейку
кристалла. Весь кристалл может быть
образован трансляцией таких ячеек.
,
с помощью которой реализуется сколь
угодно протяженный кристалл, называется
базисом решетки. Параллелепипед с
ребрами a, b,
c называется основным
(базисным) параллелепипедом или решеткой
Браве. Вместе с атомами, которые в нем
находятся, параллелепипед Браве (решетка
Браве) образует элементарную ячейку
кристалла. Весь кристалл может быть
образован трансляцией таких ячеек.
Различают 4 типа решеток Браве. а. Простая (примитивная) – узлы расположены только в вершинах параллелепипеда. В среднем на решетку Браве приходится один атом; б. Базоцентрированная, добавляется еще по одному узлу в центрах двух противоположных граней. В среднем на решетку приходится 2 атома; в. Объемноцентрированная, к узлам в углах добавляется один узел в центре, средняя плотность упаковки 2 узла на решетку Браве; г. Гранецентрированная, к узлам в углах добавляются 6 атомов в центрах всех граней. Плотность упаковки 4 узла на решетку Браве.
4. Симметрии. Это свойство тел совмещаться с самим собой при некоторых мысленных перемещениях, называемых операциями симметрии. К ним относятся параллельный перенос (трансляция), поворот тела вокруг оси, отражение в плоскости, отражение в точке. Различают следующие элементы симметрии:
П
 лоскость
симметрии, когда любая точка одной
половины кристалла совпадает с зеркальным
отражением точки другой половины
(рис.76-б).
лоскость
симметрии, когда любая точка одной
половины кристалла совпадает с зеркальным
отражением точки другой половины
(рис.76-б).
б. Поворотная ось симметрии. Если точки кристалла совмещаются с подобными им при повороте кристалла на определенный угол φ вокруг оси, то эта ось называется осью симметрии n-го порядка. В кристаллах реализуются случаи с n = 1, 2, 3, 4, 6 (рис.75-а).
в. Зеркально-поворотная ось симметрии. Одна половина тела совмещается с зеркальным отражением другой половины лишь после поворота на некоторый угол (рис.76-в).
г. Центр
симметрии. Если в теле существует
точка, обладающая свойством, что при
замене радиуса-вектора
![]() на обратный
на обратный
![]() тело переходит в состояние, неотличимое
от исходного, то эта точка называется
центром симметрии (рис.76-г).
В шаре, цилиндре, эллипсоиде, кубе
геометрический центр есть центр
симметрии.
тело переходит в состояние, неотличимое
от исходного, то эта точка называется
центром симметрии (рис.76-г).
В шаре, цилиндре, эллипсоиде, кубе
геометрический центр есть центр
симметрии.
Р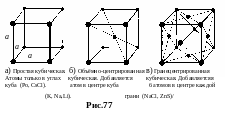 ешетки
Браве кристаллов могут иметь следующие
элементы симметрии: центр симметрии,
поворотные и зеркально поворотные оси
симметрии 1, 2, 3, 4, 6 порядков, плоскость
симметрии.
ешетки
Браве кристаллов могут иметь следующие
элементы симметрии: центр симметрии,
поворотные и зеркально поворотные оси
симметрии 1, 2, 3, 4, 6 порядков, плоскость
симметрии.
5. Системы кристаллов. Их 7. Деление кристаллов на системы производится по числу поворотных осей симметрии различных порядков, которыми обладает решетка Браве. Системы характеризуются периодами трансляции a, b, c и углами между сторонами параллелепипеда Браве α, β, γ.
Кубическая система. Параллелепипед Браве – куб. Различают 3 типа решеток Браве кубической системы: простая кубическая (рис.77-а), объемноцентрированная кубическая (рис.77-б), гранецентрированная кубическая (рис.77-в). В решетках кубической системы а = b = c, = = =90°.
П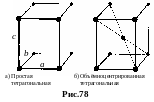 араметр
a в решетках кубической
системы называют постоянной решетки.
В металлах а 1010 м.
В простом кубе приходится в среднем
1 атом на элементарную ячейку, в
объемноцентрированном – 2 атома, в
гранецентрированном – 4 атома.
Последний тип упакован более плотно.
араметр
a в решетках кубической
системы называют постоянной решетки.
В металлах а 1010 м.
В простом кубе приходится в среднем
1 атом на элементарную ячейку, в
объемноцентрированном – 2 атома, в
гранецентрированном – 4 атома.
Последний тип упакован более плотно.
б. Тетрагональная система. Решетка Браве – прямая квадратная призма. Существует два типа – простая и объемноцентрированная (рис.78). а = b c, = = =90°.
в. Гексагональная система. Минимальный структурный элемент кристалла, передающий все виды симметрии, есть правильная шестигранная призма, в центрах оснований которой имеется по одному атому (рис.79). Эту призму можно представить как комбинацию из трех примитивных решеток Браве – призм, в основании которых ромб с острым углом 60°. Система имеет один тип. а = b c, = 60°, = =90°.

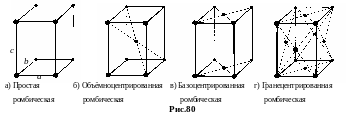 г. Ромбическая
(ортогональная) система. Решетка Браве
– прямоугольник с тремя различными
длинами ребер а b c,
= = =90°.
Реализуются все 4 типа решетки Браве
(рис.80).
г. Ромбическая
(ортогональная) система. Решетка Браве
– прямоугольник с тремя различными
длинами ребер а b c,
= = =90°.
Реализуются все 4 типа решетки Браве
(рис.80).
д. Моноклинная система. Решетка Браве есть прямая призма, в основании которой лежит произвольный параллелограмм. а b c, 90°, = =90°. Существует два типа решетки Браве моноклинной системы – простая (рис.81-а) и базоцентрированная (рис. 81-б).
е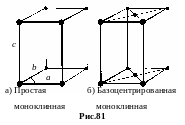 . Триклинная
система. Решетка браве представляет
собой параллелепипед произвольной
формы. а b c,
.
Существует только один тип простой
решетки (рис.82).
. Триклинная
система. Решетка браве представляет
собой параллелепипед произвольной
формы. а b c,
.
Существует только один тип простой
решетки (рис.82).
ж. Ромбоэдрическая система. Решетка Браве – ромбоэдр, то есть сжатый в направлении пространственной диагонали куб. Все грани ромбоэдра одинаковые ромбы. а = b = c, = = 90°. Решетка Браве простая (рис.83).
В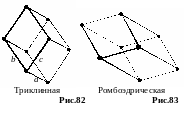 се
14 типов решеток Браве нашел только
геометрически и трактовал их как
возможные. Опыт показал, что все они
реализуются в природе.
се
14 типов решеток Браве нашел только
геометрически и трактовал их как
возможные. Опыт показал, что все они
реализуются в природе.
6. Физические типы кристаллов. По характеру химических связей между узлами различают 4 типа кристаллов: ионные, атомные, металлические и молекулярные.
Ионные кристаллы. В соседних узлах ионы противоположного знака, а весь монокристалл фактически есть одна гигантская молекула.
К ионным кристаллам относятся соли 1 и 7 групп таблицы Менделеева: NaCl, CsCl, CsF, LiCl и т.д., а также некоторые интерметаллические соединения: AuZn, MgAg, CdAg.
Н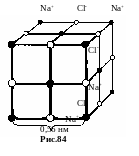 а
рис.84 показана решетка Браве поваренной
соли NaCl. Постоянная решетки
a = 0,56 нм.
Решетка относится к типу кубической
гранецентрированной системы.
а
рис.84 показана решетка Браве поваренной
соли NaCl. Постоянная решетки
a = 0,56 нм.
Решетка относится к типу кубической
гранецентрированной системы.
б. Атомные кристаллы. В узлах - нейтральные атомы с ковалентной связью между собой. Суть ее в коллективизации валентных электронов. Примером атомного кристалла является алмаз. Атомы углерода в нем удерживаются ковалентной связью. Решетку алмаза можно представить как две гранецентрированные кубические решетки, вставленные одна в другую и смещенные относительно друг друга вдоль пространственной диагонали куба на четверть ее длины. Постоянная решетки алмаза a = 0,36 нм.
в. Металлические кристаллы. В узлах - ионы одного положительного знака, между ними – слабо связанные с ионами отрицательные электроны, способные перемещаться в кристалле за счет энергии теплового движения. Это электроны проводимости, иначе, электронный газ. Обычно это металлы. Монокристаллы металлов бывают очень редко. Чаще поликристаллы, хаотично ориентированные в пространстве. Например, Li, a = 0,35 нм, Al, a = 0,4 нм, Fe, a = 0,29 нм, Cu, a = 0,36 нм.
г. Молекулярные кристаллы. В узлах - определенным образом ориентированные молекулы, связанные между собой силами Ван дер Ваальса. Например, лед H2O, твердая углекислота CO2, твердые газы H2. N2, O2.
Силы Ван дер Ваальса действуют также в кристалле графита. Графит – единственный элемент с гексагональной решеткой (рис.79). В плоскости слоев, где a = 0,25 нм, действует ковалентная связь, а между слоями (c = 0,67 нм) – силы Ван дер Ваальса. Четвертый валентный электрон в каждом атоме углерода остается свободным, поэтому добавляется еще металлическая связь. Графит имеет слоистую структуру и проводит электрический ток.
7. Дефекты в кристаллах. Это отступления в реальных кристаллах от строго регулярной структуры. Отметим следующие дефекты:
Точечные. К ним относятся вакансии (отсутствие атома в каком либо узле решетки), примесные дефекты (замена «своего» атома решетки каким-либо другим «чужим» атомом), межузельные атомы (внедрение своего или чужого атома в межузельное пространство). Пара, состоящая из межузельного иона и оставленной им вакансии, называется дефектом Френкеля.
Все точечные дефекты, за исключением примесных, имеют кинетическую природу и термодинамически равновесны. При нагревании кристалла концентрация вакансий и межузельных атомов возрастает экспоненциально;
б. Линейные дефекты. В реальных кристаллах некоторые атомные плоскости могут обрываться. Края таких оборванных плоскостей образуют дефекты, называемые краевыми дислокациями. Подвижностью дислокаций объясняется пластичность металлов;
в. Двумерные дефекты образуются границами электрических и магнитных доменов, границами разных фаз в сплавах (мартенситы в сталях);
г. Объемные дефекты образуются скоплениями вакансий, примесей, пузырьками газов.
Дефекты в кристаллах существенно изменяют их физические свойства – предел прочности, предел пластичности, спектры поглощения, рассеивания, люминесценции, электро- теплопроводность, магнитные свойства.
