
- •Раздел третий гетерогенные (фазовые) равновесия
- •3.1. Основные определения
- •3.2 Однокомпонентные системы
- •Диаграмма состояния воды
- •Ж Испарение Плавление
- •Энантиотропные и монотропные превращения
- •3.3. Двухкомпонентные системы
- •Диаграмма плавкости с простой эвтектикой.
- •Б. Химическое соединение плавится с разложением (инконгруэнтно)
- •Диаграмма состояния двухкомпонентной системы с ограниченной растворимостью компонентов в жидком состоянии. Явление ликвации.
- •Диаграммы плавкости веществ, образующих твердые растворы с неограниченной и ограниченной растворимостью
- •А. Компоненты а и в неограниченно растворимы друг в друге
- •Б. Компоненты а и в ограниченно растворимы друг в друге в твердом состоянии
- •3.4. Контрольные вопросы
3.2 Однокомпонентные системы
В однокомпонентных системах фазы состоят из одного вещества в разных агрегатных состояниях. Если вещество существует в различных кристаллических модификациях, то каждая из них является особой фазой. Например, вода образует шесть модификаций льда, сера существует в двух модификациях (ромбическая и моноклинная), олово образует белую и серую модификации. Каждая из них устойчива при определенных температуре и давлении. Из правила фаз следует, что максимально в однокомпонентной системе могут в равновесии находиться только Ф = К + 2 = 3 фазы.
Диаграмма, выражающая зависимость состояния системы от внешних условий, называется диаграммой состояния. Состояние однокомпонентной системы определяется тремя параметрами состояния системы Т, Р и V, которые связаны между собой уравнением состояния. Например, для идеального газа это уравнение имеет вид pV = nRT. Но из трех параметров только два являются независимыми, обычно давление и температура, а третий – мольный объем – является функцией давления и температуры. Поэтому диаграмму состояния однокомпонентной системы можно изобразить на плоскости в координатах Р – Т.
Диаграмма состояния воды
Вода может находиться в трех состояниях: в виде льда, жидкости и пара. При этом переход из твердого состояния в пар может быть осуществлен как через стадию плавления, так и непосредственно путем возгонки. Схематически это можно изобразить следующим образом:
Ж Испарение Плавление
Тв
ПарТв

Из схемы видно, что диаграмма (рис. 3.1) должна быть разбита на три поля тремя линиями. Каждое поле отвечает существованию одной фазы. Здесь система бивариантна (С=1+2-1 = 2). Это означает, что в пределах поля можно одновременно менять Т и Р, не изменяя числа и вида фаз.
Рис. 3.1. Диаграмма состояния воды при средних давлениях
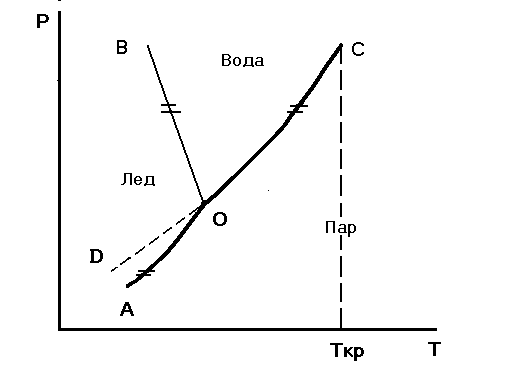
Кривые на диаграмме отвечают равновесию двух фаз: лед ↔ пар, лёд ↔ вода, вода ↔ пар. Кривая АО-кривая возгонки, ВО – плавления, ОС – испарения. В точках, лежащих на этих кривых, система обладает одной степенью свободы (С=1+2-2=1). Точка О – тройная точка, в ней в равновесии находятся три фазы. С = 1+2-3=0 Система инвариантна. Это означает, что одновременно три фазы могу существовать при единственно возможных условиях: Т=0,0076°С и Р = 4,579 мм рт. ст.
Кривая ОД соответствует давлению насыщенного пара над переохлаждённой водой. Это состояние неустойчиво, так как для него давление насыщенного пара больше, чем у льда. Внесение в переохлаждённую воду нескольких кристалликов льда приводит к быстрому её замерзанию. Кривая испарения справа ограничена точкой С. Это критическая точка, выше которой никаким увеличением давления нельзя перевести пар в жидкость.
Ход кривых АО, ОВ и ОС описывается уравнением Клаузиуса – Клайперона, показывающим зависимость давления пара фазового перехода от температуры:
![]() ,
,
где
![]()
![]() -
мольная теплота фазового перехода;
-
мольная теплота фазового перехода;
Т - температура фазового перехода;
V![]() и V
и V![]() - мольный объём вещества в конечном и
начальном состояниях.
- мольный объём вещества в конечном и
начальном состояниях.
Для
процессов плавления, испарения и возгонки
![]() положительна, поэтому наклон кривых
(знак производной dp/dT) будет
определяться разностью мольных объёмов
V
и V
.
положительна, поэтому наклон кривых
(знак производной dp/dT) будет
определяться разностью мольных объёмов
V
и V
.
Для
процессов возгонки и испарения V![]() >
V
>
V![]() и V
> V
и V
> V![]() ,
поэтому (V
-
V
)
>0 и
,
поэтому (V
-
V
)
>0 и
![]() >0. Это означает, что кривые испарения
и возгонки должны иметь положительный
наклон, т.е. увеличением температуры
давление пара над водой и льдом должно
возрастать.
>0. Это означает, что кривые испарения
и возгонки должны иметь положительный
наклон, т.е. увеличением температуры
давление пара над водой и льдом должно
возрастать.
Для
процесса плавления льда Vж
< Vтв, так как плотность
льда меньше воды, поэтому V
- V
< 0,
![]() < 0, и кривая плавления льда наклонена
влево. Это – особенность диаграммы
состояния воды. Аналогичное явление
наблюдается при плавлении висмута. Для
всех остальных веществ Vж
> Vтв и кривые плавления
имеют положительный наклон.
< 0, и кривая плавления льда наклонена
влево. Это – особенность диаграммы
состояния воды. Аналогичное явление
наблюдается при плавлении висмута. Для
всех остальных веществ Vж
> Vтв и кривые плавления
имеют положительный наклон.
При высоких давлениях существует шесть модификаций льда, различающихся по плотности.
