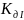- •1,Физико-химич характеристика природных вод. Основные компоненты природных вод. Классифприр вод.
- •2, Вода, как химическое соединение.
- •3.Требования, предъявляемые к качеству питьевой воды. Основные показатели химич и физические качества воды. Пдк веществ и физических показателей.
- •4,Цветность, мутность природной воды. Кислотность и щелочность воды. Виды определение.
- •5.Формы углек-ты в воде. Углекислотное равновесие воды. Определение карбонатной, гидрокарбонатной углек-ты.
- •6.Жесткость воды. Виды. Определение карбонатной и общей жесткости воды.
- •10.Ионное произведение воды (kw) (вывод). Термодинамическая константа диссоциации воды (Кα). Водородный и гидроксильный показатели. Расчет рН и рОн для сильных и слабых электролитов.
- •11.Индикаторы,типы. Теории индикаторов, их характеристика. Фенолфталеин, метиловый оранжевый. Важнейшие характеристики индикаторов. Определение рН растворов.
- •12.Как рассчитать рН буферных систем.
- •13.Электролиты. Электролитическая диссоциация, механизм диссоциации солей, кислот, оснований с ионной и полярной связью.
- •14.Степень и константа диссоциации электролитов. От каких факторов они зависят. Закон разбавления Оствальда (вывод)
- •15.Гидролиз солей.Типыгидролиза.Степень и константа гидролиза.Факторы,вызывающиеусилинеие или ослабление гидролиза данной соли.
- •16.Как протекает гидролиз соли,образованной сильным оснаванием и слабой кислотой;слабым основанием и сильной кислотой?Расчет константы ,степени гидролиза и pH для такого типа солей.
- •1.Сильноеоснавание и слабая кислота.
- •18.Дисперсные системы,ихвиды,характеристика.Суспензии,эмульсии.Методы получения коллоидных систем.
- •20.Строение гидрозоля. Строение двойного электрического поля. Кривая падения потенциала.
- •21.Методы очистки воды. Что такое фильтрация, седиментация, флотация, кальмация, сорбция? Виды сорбции.
- •22.Удаление мелко- и грубодисперсной взвеси методом отстаивания и фильтрации. Кривые седиментации моно- и полидисперсной взвеси.
- •24. Разрушение дисперсных систем.Коагуляция. Скорость и порог коагуляции. Факторы, вызывающие коагуляцию. Флокулянты, их действие и значение.
- •25. Методы обеззараживания воды. Хлорирование воды. Характеристика. Что такое активный хлор, остаточный хлор, оптимальная доза хлора. Кривая хлороёмкости воды. Как ее получить.
- •26. Виды хлорирования. Озонирование воды. Олигодинамия.
- •27.Удаление из воды Fe, Mn, h2SiO3
- •30.Методы умягчения воды: термический, реагентный и метод ионного обмена.Катиониты, аниониты.
- •2.Реагентные методы:
- •3.Метод ионного обмена:
16.Как протекает гидролиз соли,образованной сильным оснаванием и слабой кислотой;слабым основанием и сильной кислотой?Расчет константы ,степени гидролиза и pH для такого типа солей.
1.Сильноеоснавание и слабая кислота.
NaCN, CH3COONa, K2CO3, K3PO4.
NaCN: NaOH-сильный электролит,
HCN-слабый электролит
NaCN+H2O=↔NaOH+HCN
Na++CN-+HOH↔Na++OH-+HCN;
CN-+HOH↔OH-+HCN,pH>7,щелочная.
Вывод:Соль,образованная сильным осн. и слабой кисл.-гидролиз идет по аниону(кисл. остатку).Реакция среды щел. pH>7.Форма гидролиза-одноступ.
K2CO3: KOH-сильное основание
H2CO3-слабая кислота.
Ι)K2CO3 + HOH↔KOH+KHCO3
2K++CO3-+HOH↔K++OH-+K++HCO3-
CO32-+HOH↔OH-+HCO3.
II)KHCO3+HOH↔KOH+H2CO3
K++HCO3-+HOH↔K++OH-+H2O+C02
HCO3-+HOH↔OH-+CO2+H2O
В: идет по аниону CO3-.Форма гидролиза-двухступ.Среда-щелочная, т.к. pH>7.
Слабое основание и сильная кислота.
NH4CL,HCL,HBr,HI,HCNS,HNO3,HCLO4,H2SO4,CuSO4,Fe2(SO4)3.
NH4CL: NH4OH-слабое основание Kд=1,8∙10-5
HCL- сильная кислота.
NH4CL+HOH↔NH4OH+HCL
NH4++CL-+YOH↔NH4OH+H++CL-
NH4++HOH↔HN4OH+H+.
В:Гидролиз идет по катиону NH4+.Среда-кислая,Форма гидролиза-одноступ.
CuSO4: Cu(OH)2-слабый электролит
H2SO4-сильная кислота.
I)2CuSO4+2HOH↔(CuOH)2SO4+H2SO4
2Cu2++2SO42-+2H2O↔2CuOH++SO42-+2H++SO42-
Cu2++HOH↔CuOH++H+.
II)(CuOH)2SO4+2H2O↔2Cu(OH)2+H2SO4
2CuOH++SO42-+2H2O↔2Cu(OH)2+2H++SO42-
CuOH++HOH↔Cu(OH)2+H+.
Вывод:Гидролиз идет по катиону соли Cu2+.Форма гидролиза - двухступенчатая[Cu(OH)2]. Среда-кислая.pH<7. М.О-красная Ф.Ф.-бесцветная.
Расчет
константы
,степени гидролиза и pH
для 1. NH4CL
; NH4++HOH↔HN4OH+H+.
; Кд=
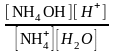 ;
Kд∙[H2O]=Kгидролиза;
[H+]=
;
Kд∙[H2O]=Kгидролиза;
[H+]=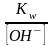
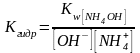
NH4OH↔NH4++OH-
: Kдис=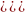 ;Кгидр=ch2-закон
разбавления Оствальда.
;Кгидр=ch2-закон
разбавления Оствальда.
h
=
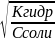 моль/л;
(%) [H+]=
моль/л;
(%) [H+]=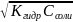 моль/л
моль/л
[H+]=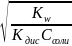 ; pH=7+1/2LgKд
осн –
1/2LgCсоли
; pH=7+1/2LgKд
осн –
1/2LgCсоли
Расчет константы ,степени гидролиза и pH для 2.
KCN:
CN-+H2O↔HCN+OH-,
pH>7
Kгидр=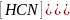 =
=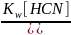 =
=
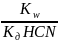 =
=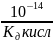
[OH-]=
;
[H+]= pH=7-1/2Lg
pH=7-1/2Lg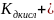 1/2Lg
1/2Lg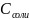
17.Как протекает гидролиз соли,образованной слабым основанием и слабой кислотой,сильным основанием и сильной кислотой?Расчет к гидролиза,h и pH для такого типа солей.У каких солей гидролиз идет до конца?
Слабоеоснавание и слабая кислота: -Солислабоготипа:
NH4CN,CH3COONH4,(NH4)2S,(NH4)2CO3
NH4CN: NH4OH-слабый электролит Кд=1,8∙10-5
HCN-слабая кислота Кд=7,2∙10-10
NH4CN+HOH↔NH4OH+HCN
NH4+HOH↔NH4OH+H+
CN+HOH↔HCN+OH-
Параллель протекают два процесса по катиону и аниону.Реакция среды-нейтральня.Определяется величиной Кд.(Кд осн>Кд.HCN) pH≥7,следовательно среда щелочная.
- соли в таблице растворимости прочерк (NH4)2SiO3 .
Al3+,Cr3+,Fe3+
S2-,SO32-,CO32-,SiO32-rfnzd94
Al2S3, Al2SiO3,Fe2(CO3)3,Cr2(SO3)3
Соли,образованные трехосновными кислотными основаниями.Подвергютсяполному,глубокомугидролизу,образуется осадок и газообразное вещество.В уравнении реакции ставиться знак равенства.
(NH4)2SiO3+HOH=NH3↑+H2O+H2SiO3(раз наSiO2 и H2O)
Fe2S3+6HOH=2Fe(OH)3↓+3H2S
2FeCl3+3Na2S→ Fe2S3 +NaCl
Расчет константы ,степени гидролиза и pH
CN3COONH4 NH4++CH3COO- +HOH↔ NH4OH+CH3COOH
Kгидр=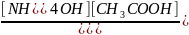
CH3COOH↔ H++ CH3COO- NH4OH↔NH4++ OH-
Kд=
Kд=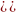
[NH4OH]= [CH3COOH]=
Kгидр=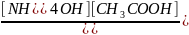 =
=
=
=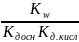
h=
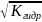 ,концентрация
соли не влият на степень гидролиза,Кгидр
и pH
,концентрация
соли не влият на степень гидролиза,Кгидр
и pH
pH=
7+ 1/2Lg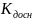 -
1/2Lg
-
1/2Lg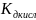
Сильное оснавание и сильная кислота
NaCl,Na2SO4,KNO3,Ca(NO3)2
NaCl+H2O↔NaOH+HCl
Na++Cl-+HOH↔Na++OH-+H++Cl-
H2O↔
OH-+H+
-Q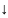
Гидролиз соли,образованной сильным оснаванием и сильной кислотой не происходит,а идет процесс диссоциации воды(эндотермический).
Na2SK2SiO3K2SO3Na3PO4,
NaHSKHSiO3KHSO3(pH<7) Na2HPO3 NaH2PO4 pH<7
S-+HOH↔HS-+ OH-
Kгидр=
=
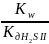 pH= 7 – ½ Lg
pH= 7 – ½ Lg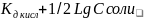
NaHS (параллельно пртекают 2 процесса диссоциации и гидролиз)
HS-↔H++
S-
-диссоциация
HS+H2O↔H2S
+OH-
- гидролиз
2HS-
+
H2O→
S2-+
H2S
Kгидр=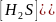 =
=
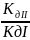 h=
h=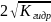 pH=
pH=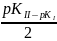 = -1/2Lg
= -1/2Lg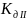 -
½ Lg
-
½ Lg