
- •1,Физико-химич характеристика природных вод. Основные компоненты природных вод. Классифприр вод.
- •2, Вода, как химическое соединение.
- •3.Требования, предъявляемые к качеству питьевой воды. Основные показатели химич и физические качества воды. Пдк веществ и физических показателей.
- •4,Цветность, мутность природной воды. Кислотность и щелочность воды. Виды определение.
- •5.Формы углек-ты в воде. Углекислотное равновесие воды. Определение карбонатной, гидрокарбонатной углек-ты.
- •6.Жесткость воды. Виды. Определение карбонатной и общей жесткости воды.
- •10.Ионное произведение воды (kw) (вывод). Термодинамическая константа диссоциации воды (Кα). Водородный и гидроксильный показатели. Расчет рН и рОн для сильных и слабых электролитов.
- •11.Индикаторы,типы. Теории индикаторов, их характеристика. Фенолфталеин, метиловый оранжевый. Важнейшие характеристики индикаторов. Определение рН растворов.
- •12.Как рассчитать рН буферных систем.
- •13.Электролиты. Электролитическая диссоциация, механизм диссоциации солей, кислот, оснований с ионной и полярной связью.
- •14.Степень и константа диссоциации электролитов. От каких факторов они зависят. Закон разбавления Оствальда (вывод)
- •15.Гидролиз солей.Типыгидролиза.Степень и константа гидролиза.Факторы,вызывающиеусилинеие или ослабление гидролиза данной соли.
- •16.Как протекает гидролиз соли,образованной сильным оснаванием и слабой кислотой;слабым основанием и сильной кислотой?Расчет константы ,степени гидролиза и pH для такого типа солей.
- •1.Сильноеоснавание и слабая кислота.
- •18.Дисперсные системы,ихвиды,характеристика.Суспензии,эмульсии.Методы получения коллоидных систем.
- •20.Строение гидрозоля. Строение двойного электрического поля. Кривая падения потенциала.
- •21.Методы очистки воды. Что такое фильтрация, седиментация, флотация, кальмация, сорбция? Виды сорбции.
- •22.Удаление мелко- и грубодисперсной взвеси методом отстаивания и фильтрации. Кривые седиментации моно- и полидисперсной взвеси.
- •24. Разрушение дисперсных систем.Коагуляция. Скорость и порог коагуляции. Факторы, вызывающие коагуляцию. Флокулянты, их действие и значение.
- •25. Методы обеззараживания воды. Хлорирование воды. Характеристика. Что такое активный хлор, остаточный хлор, оптимальная доза хлора. Кривая хлороёмкости воды. Как ее получить.
- •26. Виды хлорирования. Озонирование воды. Олигодинамия.
- •27.Удаление из воды Fe, Mn, h2SiO3
- •30.Методы умягчения воды: термический, реагентный и метод ионного обмена.Катиониты, аниониты.
- •2.Реагентные методы:
- •3.Метод ионного обмена:
11.Индикаторы,типы. Теории индикаторов, их характеристика. Фенолфталеин, метиловый оранжевый. Важнейшие характеристики индикаторов. Определение рН растворов.
Первый – лакмус. Существует > 180 индикаторов.
Индикаторы – органические соединения, которые указывают на определенное равновесие в с-ме, когда количество реагирующих веществ эквивалентны.
Типы: 1)кислотно-основные: -метиловый оранжевый, -фенолфталеин, - метиловый красный, - метиловый желтый…….
Определяют рН р-ров; являются слабыми к-тами или слабыми основаниями; в зависимости от рН меняют окраску. Используют при определении кислотности, щелочности, жесткости воды…
2)редокс индикаторы: В основе лежит окислительно-восстановительная реакция.
-крахмал, -фениландрониловая к-та.
Используют при определении концентрации О2, конц. металла, конц. ионов металла в сточной воде.
3)индикаторы метода осаждения: -Ag (CNS), -AgBr, -AgI, -K2CrO4.
Определяют галогениды, бромиды, иодиды….
4)трилонометрический метод анализ:
Основан
на образовании трудно растворимых
комплексов
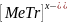 .
.
При титровании трилоном Б. Используется при определении жесткости воды.
-кислотный хром темно-синий, -эриохром черный Т….
Теория индикаторов: 1)ионная теория Оствальда:
Индикаторы – это слабые органические кислоты или основания, у которых молекулы и ионы имеют различную окраску.
HInd⇄ H+ +Ind-ф.ф
кислотная щелочная
форма(бесцв.) форма(роз.)
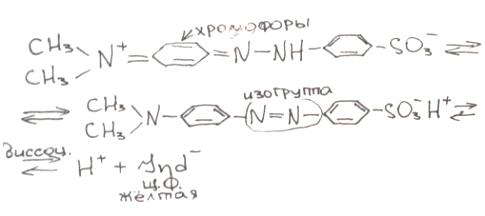
2)хромофорная теория:
Индикатор содержит 2 атомные группировки: хромофоры и ауксохромы.
Хромофоры – атомные группировки, кот. Придают окраску индикатору.
Азокрасители: -N=N- =N-NH- -N=O =N-OH
Ауксохромы – атомные группировки, кот.не обладают окраской, но их присустсвие усиливает окраску хромофор
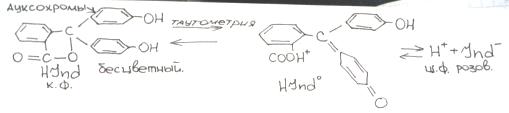
3)ионно-хромофорная теория: Если к титруемому р-ру с определенным рН добавить 2-3 капли индикатора, то будут протекать процессы таутомерии (внутриатомная группировка) и процесс диссоциации индикатора. И в зависимости от рН установится в р-ре кислотная или щелочная форма индикатора.
Кислотная форма – это та форма, цвет которой преобладает в кислой среде. Щелочная - -//- в щелочной среде.
Фенолфталеин (ф.ф). Белое кристальное в-во, плохо растворяется в воде, хорошо – в спирте.
Применяется 1% спиртовой раствор ф.ф. Индикатор действует в щелочной среде рН=8 – 10… <8-бесцветный; 10 и >- розовый (малиновый).
(C6H4OH)2COOC6H4 – формула ф.ф
Метиловый оранжевый (м.о). Окрашенная соль, 1% водный р-р, действует в кислой среде рН 3,1-4,4 (красный – оранжевый – желтый)
Характеристика индикаторов:
рН
рТ (показатель титрования, при которых происходит наибольшее значение цветности) рТ 9-ф.ф, 4,0-м.о
рk – силовой показатель индикатора. pk = -lgKд , рН = -lgKд - lg
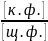
12.Как рассчитать рН буферных систем.
Буферные растворы- это растворы,водородный показатель которых почти не меняется от разбавления их водой и сравнительно мало изменяется от внесения в них небольшого количества сильных кислот или щелочей.
Свойства: 1.Концентрация водородных ионов в буферных растворах не зависит от разбавления.
2.Концентрация водородных ионов буферных растворов мало изменяется от прибавления кислот и оснований.
Буферные
системы: а)из слабых кислот и их солей
(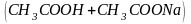 -щелочные
-щелочные
б)
из слабых оснований и их солей
 -кислотные
-кислотные
в)
из кислых солей и ______ кислот
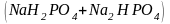 -нейтральные
-нейтральные
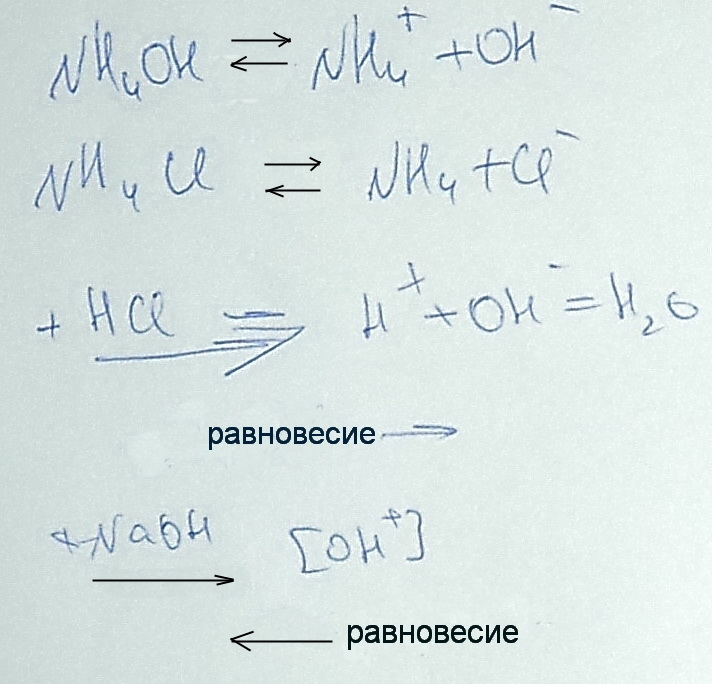
При определении общеё жесткости мы используем аммонийно буферный раствор для поддержания
pH
= 9,2-9,5;
pH>7
;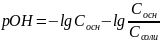
;pH
=14-pOH ;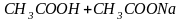
 pH<7
pH<7
