
- •Тема 1. Законы термодинамики
- •§1. Предмет физической химии. Проблемы и методы физической химии.
- •§2. Первый закон термодинамики.
- •§3. Применение I закона термодинамики к простейшим процессам.
- •§4. Примеры решения задач.
- •§5. Термодинамические расчеты. Закон Гесса.
- •§ 6. Теплота образования.
- •§7. Теплота сгорания.
- •§8. Зависимость теплового эффекта реакции от температуры.
- •§9. Температурная зависимость теплоемкостей.
- •§10. Примеры решения задач.
- •Таким образом
- •§11. Второй закон термодинамики.
- •§12. Необратимые и обратимые процессы.
- •§13. Математическое выражение второго закона термодинамики.
- •§14. Цикл Карно.
- •§15. Вычисление изменения энтропии при различных процессах.
- •§16. Примеры решения задач.
- •§17. Термодинамические функции: энергия Гиббса и энергия Гельмгольца.
- •§18. Зависимость свободной энергии и энтропии от параметров состояния.
- •§19. Примеры решения задач.
- •§20. Уравнение Клаузиуса- Клайперона.
- •§21. Примеры решения задач:
- •§22. III закон термодинамики.
- •Тема 2. Химическое равновесие.
- •§1. Химическое равновесие в гомогенных системах.
- •§2. Различные формы констант равновесия.
- •§3. Расчет выхода реакции.
- •§4. Изотерма химической реакции.
- •§5. Зависимость константы равновесия от температуры.
- •§6. Гетерогенные химические реакции.
- •§7. Расчеты химического равновесия по таблицам стандартных термодинамических величин.
- •§8. Примеры решения задач.
- •Таким образом
- •Под величиной lnP подразумевается логарифм отношения исходных парциальных давлений продуктов реакции и исходных веществ в степенях соответствующих их стехиометрическим коэффициентам.
- •Тема 3. Фазовые равновесия.
- •§1. Основные определения. Условия равновесия в многофазных системах. Правило фаз Гиббса.
- •§2. Вывод правила фаз Гиббса
- •§3. Диаграммы равновесия двухкомпонентных систем.
- •§3.1. Первый тип диаграмм. Компоненты а и в неограниченно взаимно растворимы в жидком состоянии, а в твердом состоянии не образуют ни растворов, ни соединений.
- •§3.2. Правило рычага.
- •§3.3. Второй тип диаграмм. Компоненты а и в неограниченно растворимы друг в друге как в жидком, так и в твердом состоянии и не образуют между собой химических соединений.
- •§3.4. Третий тип диаграмм. Компоненты а и в имеют ограниченную взаимную растворимость в твердом состоянии и неограниченную взаимную растворимость в жидком состоянии.
- •§3.5. Четвертый тип диаграмм. Компоненты а и в образуют прочные химические соединения, устойчивые вплоть до температуры плавления.
- •§3.6. Пятый вид диаграмм. Компоненты а и в образуют непрочное соединение, разлагающееся ниже температуры плавления.
- •§3.7. Пример.
- •Тема 4. Термодинамическая теория растворов.
- •§1. Основные определения.
- •§2. Способы выражения концентраций растворов.
- •§3. Примеры решения задач.
- •§4. Парциальные мольные величины.
- •§5. Бесконечно-разбавленные растворы.
- •§6. Давление пара растворенного вещества.
- •§7. Давление пара растворителя.
- •Сколько олова нужно растворить в 50 г ртути, чтобы давление пара ртути понизилось от 709,9 до 700 мм.Рт.Ст.
- •§8. Температуры кипения и замерзания разбавленных растворов нелетучих веществ.
- •§9. Осмотическое давление.
- •§10. Закон действующих масс для разбавленных растворов.
- •§11. Закон распределения.
- •§12. Совершенные растворы.
- •§13. Давление пара.
- •§14. Закон действующих масс.
- •§15. Растворимость.
- •§15. Неидеальные растворы. Отклонения от идеальности.
- •§16. Термодинамическая активность.
- •§17. Выбор стандартного состояния.
- •§18. Закон действующих масс.
- •§19. Распределение компонентов между фазами.
- •§20. Связь между активностями компонентов.
- •§21. Методы определения активности.
- •Измерение давления пара.
- •Изучение химического равновесия.
- •Определение активности по закону распределения.
§21. Примеры решения задач:
Пример 1.
Плотности жидкого и твердого олова при температуре плавления (231,9С) соответственно равны 6,988 и 7,184 г/см3. Теплота плавления олова равна 1690 кал/моль. Определите температуру плавления олова под давлением 100 атм.
Определяем изменение
температуры плавления при повышении
давления на 1 атм., т.е. величину
![]() ,
которая определяется из уравнения
Клаузиуса-Клайперона:
,
которая определяется из уравнения
Клаузиуса-Клайперона:
![]() ,
где
,
где
Т – температура плавления под давлением 1 атм.
- разность удельных объемов жидкого и твердого олова.
Т = 231,9+273 = 504,9 К.
![]() см3/г.
см3/г.
В каких единицах должна выражаться теплота олова, чтобы слева от знака равенства размерность была [К/атм].
![]() ,
отсюда видно, что Q должна
измеряться в
,
отсюда видно, что Q должна
измеряться в
![]() .
.
Произведем пересчет. Сначала переведем калории в литр-атмосферы.
1690 кал/моль - 1,987 кал/моль.К
Q л-атм/моль - 0,082 л-атм/моль.К
![]() л-атм/моль.
л-атм/моль.
Разделим, найденное число на атомную массу олова:
![]() л-атм/г.
Получим удельную теплоту плавления.
л-атм/г.
Получим удельную теплоту плавления.
Переведем литры в см3, т.е. умножим на 1000: Q = 0,588.1000 = 588 см3-атм/г.
![]() К/атм.
К/атм.
Рассчитаем температуру плавления олова при давлении 100 атм.
![]() К.
К.
Пример 2.
Давление пара метилового спирта при 20С равно 94 мм рт. ст., а при 40С – 259,4 мм рт.ст. Определите среднее значение теплоты испарения спирта в указанном интервале температур.
Воспользуемся
уравнением
![]() .
.
Проинтегрируем: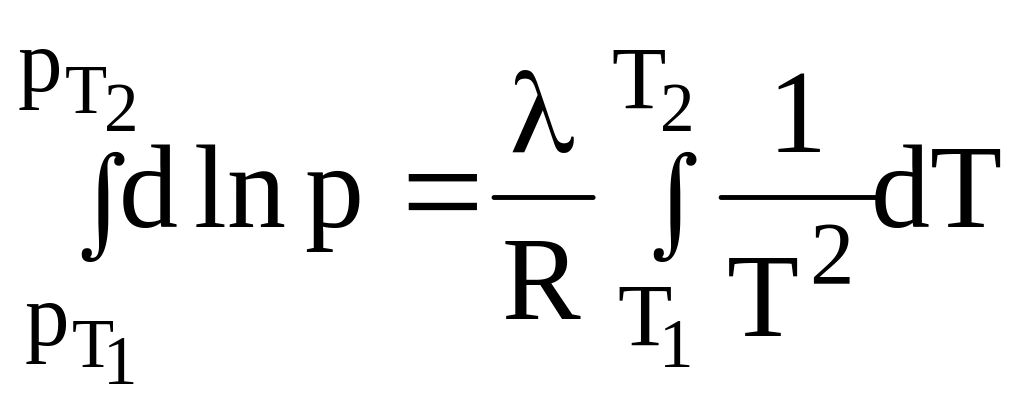 .
.
Получим: или
или
 .
.
 Дж/моль.
Дж/моль.
Пример 3.
Зависимость давления пара хлороформа от температуры показана в таблице. Определите теплоту испарения графическим методом.
Т, К |
293 |
303 |
313 |
323 |
333 |
р, атм. |
0,21 |
0,33 |
0,49 |
0,70 |
0,99 |
Преобразуем
уравнение Клаузиуса-Клайперона
![]()
![]() .
.
Если построить
график рТ, то тангенс
угла наклона касательной в точке будет
производная
![]() .
Зная давление и температуру в этой
точке, можно найти теплоту испарения.
.
Зная давление и температуру в этой
точке, можно найти теплоту испарения.
Найдем ее для температуры 313 К. Для этого проведем касательную к точке на графике, соответствующей данной температуре и рассчитаем tg. Для этого возьмем любой, удобный нам треугольник, например, такой, как показан на рисунке и возьмем отношение противолежащего катета к прилежащему.
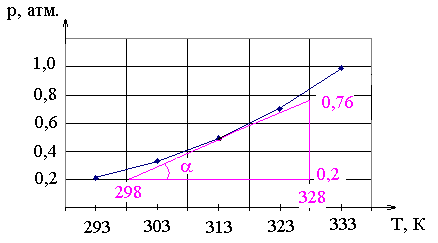
![]() атм/К.
атм/К.
 Дж/моль.
Дж/моль.![]()
§22. III закон термодинамики.
В 1906 году Вальтером Нернстом было высказано простое и довольно вероятное предположение, что кривые Н=ƒ(Т) и G=ƒ(T) не только встречаются при Т=0 К, но и касаются. Другими словами, обе кривые вблизи абсолютного нуля имеют общую касательную.
Кроме того при очень низких температурах свойства твердых и жидких тел перестают зависеть от температуры, а это требует, чтобы общая касательная шла параллельно оси температур, т.е.
![]() ;
;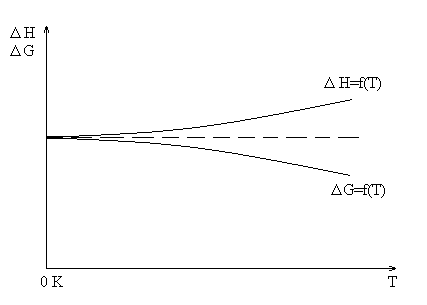
![]()
Таково основное содержание высказанных Нернстом положений, относящихся к свойствам конденсированных систем и получивших название тепловой теоремы Нернста.
Действительно, по мере приближения к абсолютному нулю свойства тел все менее зависят от температуры. Это явление называется вырождением. Тело, свойства которого при данной точности опыта не зависит от температуры, называется вырожденным.
Опыт показывает, что вблизи абсолютного нуля вообще все термические коэффициенты, выражающие зависимость свойств тела от температуры, стремятся к нулю. Область температур, в которой наступает вырождение, различна для различных тел. Так, для алмаза состояние вырождения достигается при довольно далекой от абсолютного нуля температуре – около 90 К. Это означает, что ниже 90 К при любой температуре, например, при 10 или 70 К, свойства алмаза (объем, энергия и др.), зависящие от температуры, будут иметь в пределах существующей точности измерений одинаковые значения.
В зависимости от кристаллической структуры и массы частиц различные тела характеризуются разными температурами перехода в вырожденное состояние. Явление вырождения, наблюдающееся у всех тел, отражает общее всем телам свойство. Это позволяет считать, что может быть выведен общий новый принцип. Таким принципом является третий закон термодинамики.
Первое утверждение
третьего закона термодинамики состоит
в том, что при приближении температуры
к абсолютному нулю величины теплоемкостей
(Ср и СV) всех
тел становятся равными нулю. Это
соответствует тому, что в вырожденном
состоянии внутренняя энергия и
теплосодержание тел не зависят от
температуры, т.к.
![]() и
и
![]() .
.
Это утверждение основывается на многочисленных измерениях теплоемкостей при низких температурах. В рамках термодинамики оно принимается как аксиоматическое.
При низких
температурах величины термодинамических
функций не зависят от температуры. В
частности это относится к свободной
энергии, откуда следует, что
![]() .
Следовательно:
.
Следовательно:
![]() .
.
Второе утверждение третьего закона термодинамики состоит в том, что энтропия простых кристаллических тел стремится к нулю при приближении температуры к абсолютному нулю.
Эти два утверждения и являются выражением третьего закона термодинамики. Следует отметить, что оба указанных утверждения не являются независимыми друг от друга, т.к. из второго может быть выведено первое. Энтропия может достигнуть нулевого значения лишь при условии, что теплоемкость обращается в ноль, как это следует из уравнения:
![]() .
.
Если Ср при Т0 не стремится к нулю, то энтропия будет бесконечно велика.
Обычно при изложении третьего закона ограничиваются вторым утверждением, известным как формулировка Планка. Следует отметить, что первое утверждение не имеет исключений и в равной степени относится к газам, твердым телам, жидкостям и растворам. Второе утверждение относится к кристаллическим телам и неприменимо к растворам, переохлажденным жидкостям и некоторым веществам в твердом состоянии, например, Н2, СО, NO.
В соответствии с постулатом Планка возможно определение абсолютного значения энтропии. Поскольку энтропия чистого кристаллического вещества при абсолютном нуле S0K равна нулю, то при любой другой температуре ее значение может быть найдено из уравнения:
![]() .
.
Если имеются точные данные о теплоемкостях при низких температурах, а также тепловые эффекты и температуры всех фазовых переходов, если они имеют место в этом температурном интервале.
Абсолютные значения энтропии необходимы, в частности, для расчета Sр-ции. Например:
A+B=2D
Sр-ции=2SD-SA-SB.
Определение абсолютных значений энтропий осуществляется графическим способом.
С помощью калориметра осуществляется измерение теплоемкостей. В калориметр вводится точно измеряемое количество тепла путем пропускания электрического тока и при помощи чувствительного термометра измеряется соответствующее повышение температуры.
Графический метод заключается в построении кривой в координатах СрlnT.

Точка В соответствует наиболее низкой температуре, при которой для данного вещества возможны надежные изменения теплоемкостей (обычно 10-15 К).
Теплоемкость при
температурах близких к абсолютному
нулю (отрезок АВ) можно вычислить по
уравнению Дебая, согласно которому
СТ3. Площадь,
ограниченная кривой АВС, осью lnT,
дает величину энтропии твердого тела
при этой температуре. Точка С соответствует
Тпл твердого тела, при которой
происходит резкое увеличение теплоемкости,
и отрезок DE представляет
теплоемкость жидкости. При плавлении
происходит поглощение тепла Нпл,
приводящее к увеличению энтропии на
величину
![]() .
.
Точка Е соответствует
температуре кипения жидкости при
атмосферном давлении. Площадь, ограниченная
кривой DE и ординатами Тпл
и Ткип, дает увеличение энтропии
при нагревании жидкости между этими
температурами. При температуре кипения
происходит резкое уменьшение теплоемкости
до величины, соответствующей теплоемкости
газа (точка К). При испарении энтропия
возрастает на величину![]() .
.
Дальнейшее увеличение энтропии газа определяется величиной площади, лежащей под кривой KL. В случае, если в твердом состоянии тело претерпевает полиморфное превращение, то так же необходимо учесть соответствующее увеличение энтропии:
![]() .
.
Таким образом, если учесть все стадии, то можно записать выражение для ST.
 .
.
График можно также
строить в координатах
![]() .
.
Понятно, что площадь под графиком соответствует энтропии при данной температуре Т за вычетом изменений энтропий при фазовых переходах.
