
- •Тема 1. Законы термодинамики
- •§1. Предмет физической химии. Проблемы и методы физической химии.
- •§2. Первый закон термодинамики.
- •§3. Применение I закона термодинамики к простейшим процессам.
- •§4. Примеры решения задач.
- •§5. Термодинамические расчеты. Закон Гесса.
- •§ 6. Теплота образования.
- •§7. Теплота сгорания.
- •§8. Зависимость теплового эффекта реакции от температуры.
- •§9. Температурная зависимость теплоемкостей.
- •§10. Примеры решения задач.
- •Таким образом
- •§11. Второй закон термодинамики.
- •§12. Необратимые и обратимые процессы.
- •§13. Математическое выражение второго закона термодинамики.
- •§14. Цикл Карно.
- •§15. Вычисление изменения энтропии при различных процессах.
- •§16. Примеры решения задач.
- •§17. Термодинамические функции: энергия Гиббса и энергия Гельмгольца.
- •§18. Зависимость свободной энергии и энтропии от параметров состояния.
- •§19. Примеры решения задач.
- •§20. Уравнение Клаузиуса- Клайперона.
- •§21. Примеры решения задач:
- •§22. III закон термодинамики.
- •Тема 2. Химическое равновесие.
- •§1. Химическое равновесие в гомогенных системах.
- •§2. Различные формы констант равновесия.
- •§3. Расчет выхода реакции.
- •§4. Изотерма химической реакции.
- •§5. Зависимость константы равновесия от температуры.
- •§6. Гетерогенные химические реакции.
- •§7. Расчеты химического равновесия по таблицам стандартных термодинамических величин.
- •§8. Примеры решения задач.
- •Таким образом
- •Под величиной lnP подразумевается логарифм отношения исходных парциальных давлений продуктов реакции и исходных веществ в степенях соответствующих их стехиометрическим коэффициентам.
- •Тема 3. Фазовые равновесия.
- •§1. Основные определения. Условия равновесия в многофазных системах. Правило фаз Гиббса.
- •§2. Вывод правила фаз Гиббса
- •§3. Диаграммы равновесия двухкомпонентных систем.
- •§3.1. Первый тип диаграмм. Компоненты а и в неограниченно взаимно растворимы в жидком состоянии, а в твердом состоянии не образуют ни растворов, ни соединений.
- •§3.2. Правило рычага.
- •§3.3. Второй тип диаграмм. Компоненты а и в неограниченно растворимы друг в друге как в жидком, так и в твердом состоянии и не образуют между собой химических соединений.
- •§3.4. Третий тип диаграмм. Компоненты а и в имеют ограниченную взаимную растворимость в твердом состоянии и неограниченную взаимную растворимость в жидком состоянии.
- •§3.5. Четвертый тип диаграмм. Компоненты а и в образуют прочные химические соединения, устойчивые вплоть до температуры плавления.
- •§3.6. Пятый вид диаграмм. Компоненты а и в образуют непрочное соединение, разлагающееся ниже температуры плавления.
- •§3.7. Пример.
- •Тема 4. Термодинамическая теория растворов.
- •§1. Основные определения.
- •§2. Способы выражения концентраций растворов.
- •§3. Примеры решения задач.
- •§4. Парциальные мольные величины.
- •§5. Бесконечно-разбавленные растворы.
- •§6. Давление пара растворенного вещества.
- •§7. Давление пара растворителя.
- •Сколько олова нужно растворить в 50 г ртути, чтобы давление пара ртути понизилось от 709,9 до 700 мм.Рт.Ст.
- •§8. Температуры кипения и замерзания разбавленных растворов нелетучих веществ.
- •§9. Осмотическое давление.
- •§10. Закон действующих масс для разбавленных растворов.
- •§11. Закон распределения.
- •§12. Совершенные растворы.
- •§13. Давление пара.
- •§14. Закон действующих масс.
- •§15. Растворимость.
- •§15. Неидеальные растворы. Отклонения от идеальности.
- •§16. Термодинамическая активность.
- •§17. Выбор стандартного состояния.
- •§18. Закон действующих масс.
- •§19. Распределение компонентов между фазами.
- •§20. Связь между активностями компонентов.
- •§21. Методы определения активности.
- •Измерение давления пара.
- •Изучение химического равновесия.
- •Определение активности по закону распределения.
§17. Термодинамические функции: энергия Гиббса и энергия Гельмгольца.
В изолированных системах энтропия может только увеличиваться при необратимых процессах и при равновесии достигать максимума. Поэтому ее можно использовать для суждения о направлении процессов в изолированной системе. Однако на практике большинство процессов протекает в неизолированных системах. Действие почти всех промышленных агрегатов связано с теплообменом и изменениями объема. Поэтому для таких незамкнутых систем целесообразно выбрать другие критерии равновесия. Возможность или невозможность процессов при этом связывается с работой, которую они могут произвести. Т.К. работа зависит от пути процесса, то ее нельзя выбрать в качестве критерия. Но если ограничить рассмотрение частным случаем процесса при постоянной температуре, то максимальная работа при его обратимом протекании определяется изменением некоторой функции состояния.
![]()
![]() (15)
(15)
Уравнение (15) носит название объединенного уравнения I и II законов термодинамики.
![]()
![]()
![]()
![]() (16)
(16)
Уравнение (16) вводит новую функцию состояния А – свободную энергию при постоянном объеме или энергию Гельмгольца.
При обратимом изотермическом процессе работа равна убыли некоторой функции состояния A=U-TS, называемой свободной энергией при постоянном объеме.
Убыль свободной энергии при обратимом изотермическом процессе равна произведенной работе.
Если к условию
постоянства температуры добавить
условие постоянства объема, т.е.
![]() ,
то получим
,
то получим
![]() или
или
![]() .
.
Отсюда следует, что при постоянных температуре и объеме свободная энергия не изменяется при обратимых процессах, а при необратимых может только убывать. Это означает, что функция А является критерием, который позволяет судить о направлении процессов в незамкнутых системах. Очевидно, для таких систем условием равновесия является минимум свободной энергии (при V и T=const).
В технике большинство процессов совершается при постоянном давлении. Поэтому кроме свободной энергии при постоянном объеме целесообразно ввести такую функцию состояния, которая служила бы критерием равновесия в условиях постоянства давления и температуры.
Если объем системы изменяется, то
![]()
![]()
При постоянстве давления:
![]() .
.
Таким образом, новая функция состояния G называющаяся свободной энергией при постоянном давлении (энергией Гиббса, изобарно-изотермическим потенциалом) определяется уравнением:
![]() .
.
При обратимых процессах величина энергии Гиббса не изменяется, а при необратимых может только убывать. Следовательно, условием равновесия в системах при постоянных p и T является минимум энергии Гиббса.
Может быть более наглядной будет связь между различными функциями состояния, если изобразить ее графически.

§18. Зависимость свободной энергии и энтропии от параметров состояния.
Найдем выражения для функций A и G одного моля идеального газа. Из определения теплоемкости при постоянном объеме следует, что
![]() ,
,
где U0 – внутренняя энергия тела при абсолютном нуле.
A=U-TS
Энтропия идеального газа при постоянной температуре растет с увеличением объема и уменьшается при увеличении давления.
![]()
![]() ,
,
где I – постоянная интегрирования.
![]() ,
,
где
![]() - постоянная величина, зависящая только
от температуры. Заменяя
- постоянная величина, зависящая только
от температуры. Заменяя
![]() ,
получим
,
получим
![]()
Т.к. G=A+pV, то для идеального газа G=A+RT.
Введя RT в функцию D’(T), находим, что
G=L(T)+RTlnp.
Величину L(T) часто обозначают через G0.
Функции A и G широко используются для анализа возможности различных процессов и реакций.
Пусть, например, мы хотим выяснить, возможно ли превращение графита в алмаз при данных p и T. Если G(алмаза)>G(графита), то G= G(алмаза)- G(графита)>0, такой процесс невозможен. Однако для других p и T знак величины G может измениться на обратный. Действительно, сейчас этот процесс осуществляется при Т≈3000 К и р≈100000 атм.
Для решения большого числа подобных задач необходимо знать зависимость функций A и G от T, V и p.
A=U-TS
Продифференцировав это уравнение:
dA=dU-TdS-SdT
и подставив в него значение TdS=Q=dU+pdV, получим
dA=-pdV-SdT.
Это уравнение дает зависимость энергии Гельмгольца от V и T.
![]() (17)
(17)
![]() (18)
(18)
Дифференцируя уравнение G=U-TS+pV, получим:
dG=dU-TdS-SdT+pdV+Vdp.
Подставляя значение TdS, получаем
dG=Vdp-SdT.
Откуда следует, что
![]() (19)
(19)
![]() (20)
(20)
Подставив выражения из уравнения (18) и (20) в выражения для энергии Гиббса и энергии Гельмгольца, получим:
![]() (21)
(21)
![]() (22)
(22)
Уравнения (21) и (22) носят название уравнений Гиббса-Гельмгольца. Они дают зависимость свободной энергии при постоянном объеме (энергии Гельмгольца) и при постоянном давлении (энергии Гиббса) от температуры для однородного вещества. Эти уравнения могут быть представлены в более удобном виде, так разделив обе части уравнения на Т2, получим:
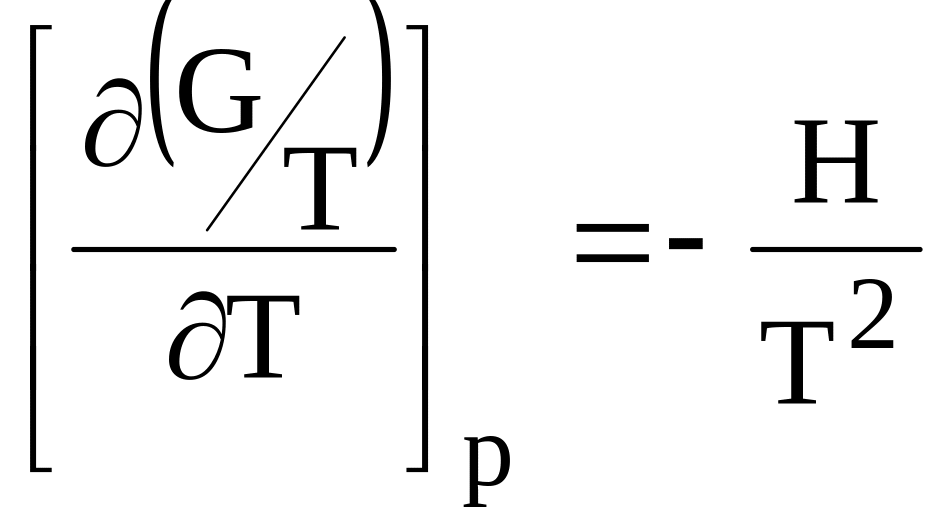 (23)
(23)
или
![]() (24)
(24)
Уравнения (21), (22), (23) для изменений функций A и G, т.е. для процессов, принимают вид:
![]()
![]()
 .
.
Еще раз об определении направления процесса в различных системах:
для изолированных систем:
dS0 знак = относится к равновесному состоянию
> к самопроизвольным процессам
для неизолированных систем:
при T и V – const
dA0 самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением энергии Гельмгольца, причем пределом их протекания является достижении е некоторого минимального значения энергии Гельмгольца для данных условий (или при A<0 – возможен самопроизвольный процесс, при A>0 возможен обратный процесс, а при A=0 – состояние равновесия).
при T и р – const
dG0 самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением энергии Гиббса, причем пределом их протекания является достижении е некоторого минимального значения энергии Гиббса для данных условий (или при G<0 – возможен самопроизвольный процесс, при G>0 возможен обратный процесс, а при G=0 – состояние равновесия).
