
- •Тема 1. Законы термодинамики
- •§1. Предмет физической химии. Проблемы и методы физической химии.
- •§2. Первый закон термодинамики.
- •§3. Применение I закона термодинамики к простейшим процессам.
- •§4. Примеры решения задач.
- •§5. Термодинамические расчеты. Закон Гесса.
- •§ 6. Теплота образования.
- •§7. Теплота сгорания.
- •§8. Зависимость теплового эффекта реакции от температуры.
- •§9. Температурная зависимость теплоемкостей.
- •§10. Примеры решения задач.
- •Таким образом
- •§11. Второй закон термодинамики.
- •§12. Необратимые и обратимые процессы.
- •§13. Математическое выражение второго закона термодинамики.
- •§14. Цикл Карно.
- •§15. Вычисление изменения энтропии при различных процессах.
- •§16. Примеры решения задач.
- •§17. Термодинамические функции: энергия Гиббса и энергия Гельмгольца.
- •§18. Зависимость свободной энергии и энтропии от параметров состояния.
- •§19. Примеры решения задач.
- •§20. Уравнение Клаузиуса- Клайперона.
- •§21. Примеры решения задач:
- •§22. III закон термодинамики.
- •Тема 2. Химическое равновесие.
- •§1. Химическое равновесие в гомогенных системах.
- •§2. Различные формы констант равновесия.
- •§3. Расчет выхода реакции.
- •§4. Изотерма химической реакции.
- •§5. Зависимость константы равновесия от температуры.
- •§6. Гетерогенные химические реакции.
- •§7. Расчеты химического равновесия по таблицам стандартных термодинамических величин.
- •§8. Примеры решения задач.
- •Таким образом
- •Под величиной lnP подразумевается логарифм отношения исходных парциальных давлений продуктов реакции и исходных веществ в степенях соответствующих их стехиометрическим коэффициентам.
- •Тема 3. Фазовые равновесия.
- •§1. Основные определения. Условия равновесия в многофазных системах. Правило фаз Гиббса.
- •§2. Вывод правила фаз Гиббса
- •§3. Диаграммы равновесия двухкомпонентных систем.
- •§3.1. Первый тип диаграмм. Компоненты а и в неограниченно взаимно растворимы в жидком состоянии, а в твердом состоянии не образуют ни растворов, ни соединений.
- •§3.2. Правило рычага.
- •§3.3. Второй тип диаграмм. Компоненты а и в неограниченно растворимы друг в друге как в жидком, так и в твердом состоянии и не образуют между собой химических соединений.
- •§3.4. Третий тип диаграмм. Компоненты а и в имеют ограниченную взаимную растворимость в твердом состоянии и неограниченную взаимную растворимость в жидком состоянии.
- •§3.5. Четвертый тип диаграмм. Компоненты а и в образуют прочные химические соединения, устойчивые вплоть до температуры плавления.
- •§3.6. Пятый вид диаграмм. Компоненты а и в образуют непрочное соединение, разлагающееся ниже температуры плавления.
- •§3.7. Пример.
- •Тема 4. Термодинамическая теория растворов.
- •§1. Основные определения.
- •§2. Способы выражения концентраций растворов.
- •§3. Примеры решения задач.
- •§4. Парциальные мольные величины.
- •§5. Бесконечно-разбавленные растворы.
- •§6. Давление пара растворенного вещества.
- •§7. Давление пара растворителя.
- •Сколько олова нужно растворить в 50 г ртути, чтобы давление пара ртути понизилось от 709,9 до 700 мм.Рт.Ст.
- •§8. Температуры кипения и замерзания разбавленных растворов нелетучих веществ.
- •§9. Осмотическое давление.
- •§10. Закон действующих масс для разбавленных растворов.
- •§11. Закон распределения.
- •§12. Совершенные растворы.
- •§13. Давление пара.
- •§14. Закон действующих масс.
- •§15. Растворимость.
- •§15. Неидеальные растворы. Отклонения от идеальности.
- •§16. Термодинамическая активность.
- •§17. Выбор стандартного состояния.
- •§18. Закон действующих масс.
- •§19. Распределение компонентов между фазами.
- •§20. Связь между активностями компонентов.
- •§21. Методы определения активности.
- •Измерение давления пара.
- •Изучение химического равновесия.
- •Определение активности по закону распределения.
§16. Примеры решения задач.
Пример 1.
Найдите изменение энтропии при переходе 1 моля азота от 25С и неизвестного объема к 200С и V2=50 л. p=const.
Эту задачу можно решить двумя способами. Можно воспользоваться условием, что давление постоянно, но тогда возникает вопрос, а зачем дан объем?
Можно решить задачу, разложив на две: сначала рассмотреть изохорический нагрев, а потом изотермическое расширение.
Решим двумя способами и убедимся, что результат будет одинаковым.
Способ 1.
p=const.
![]() Дж/К
Дж/К
Азот газ двухатомный, поэтому СV=5/2R, а Сp=Cv+R=7/2R
Способ 2.
1. Изохорический нагрев
![]() Дж/К
Дж/К
2. Прежде чем рассматривать изотермическое расширение, надо найти неизвестный первый объем. Это можно сделать, воспользовавшись условием, что давление постоянно и уравнением Менделеева-Клайперона.
![]() л.
л.
![]() Дж/К
Дж/К
![]() Дж/К
Дж/К
Как видно из решения, обоими способами получился одинаковый результат. Это возможно, поскольку энтропия является функцией состояния.
Пример 2.
Вычислите изменение энтропии, происходящее при расширении до 1000 см3 и одновременном нагревании до 100С аргона, содержащегося в сосуде, объемом 500 см3 при 25С и начальном давлении 1 атм.
Задача похожа на предыдущую, но из условия ясно, что постоянного параметра нет. Меняется и температура, и давление, и объем. В таком случае решаем задачу вторым способом, т.е. сначала рассчитываем изотермическое расширение, потом изохорическое нагревание, а можно изотермическое расширение и изобарический нагрев, результат будет одинаковым.
Сначала найдем число молей аргона, для этого нам дано давление 1 атм. Воспользуемся уравнением Менделеева-Клайперона.
![]() моля
моля
Изобразим процесс графически, чтобы было нагляднее.

1.
![]() Дж/К
Дж/К
2.
![]() Дж/К
Дж/К
Поскольку аргон – одноатомный газ, принимаем CV=3/2R.
3.
![]() Дж/К
Дж/К
Пример 3.
Два моля идеального одноатомного газа при начальном давлении 1 атм. и температуре 300 К были проведены через следующий цикл, все стадии которого обратимы:
I – изотермическое сжатие до 2 атм.
II – изобарическое нагревание до 400 К.
III – возвращение в исходное состояние.
Изобразите цикл графически и определите изменение энтропии на каждой стадии.

1. Процесс изотермический.
![]() Дж/К
Дж/К
2. Процесс изобарический.
![]() Дж/К
Дж/К
Поскольку газ одноатомный, принимаем СV=3/2R, Cp=CV+R.
3. Поскольку энтропия функция состояния изменение энтропии всего процесса в целом будет равно нулю, т.к. начальное и конечное состояние системы – это одна и та же точка.
![]()
![]() Дж/К
Дж/К
Пример 4.
Вычислить изменение энтропии при нагреве 20 г индия от 25С до 500С, если индий плавится при температуре 430 К и Нпл=3,283 кДж/моль.
Ср(тв)=18,297+24,172.10-3Т
Ср(ж)=27,456+1,092.10-3Т
Изменение энтропии при нагреве индия от 25С до 500С будет складываться из трех частей.
1. Изменение энтропии при нагреве твердого In от 25С (298 К) до Тпл=430 К.
АIn=115 г/моль
Число молей индия:
![]() моль
моль
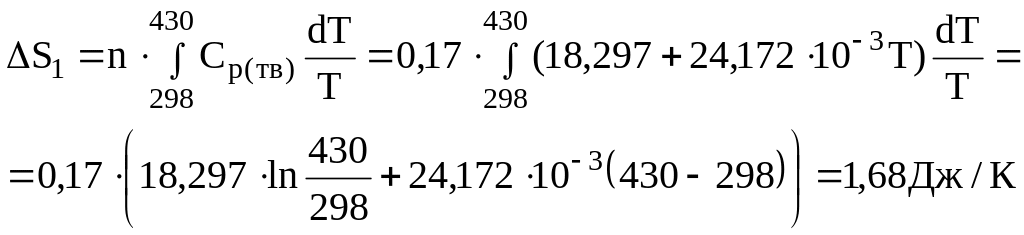
2. Изменение энтропии при плавлении:
![]()
3. Изменение энтропии при нагреве жидкого In от Тпл=430 К до 500С (773 К).

S=S1+S2+S3=1,68+1,3+2,8=5,78
![]() .
.
Пример 5.
Рассчитайте изменение энтропии при реакции 2H2(газ)+СО(газ)=СН3ОН(газ) при температуре 500 К с помощью таблиц стандартных термодинамических величин.
|
Н2 |
СО |
СН3ОН |
S298, Дж/моль.К |
130,6 |
197,4 |
239,7 |
а |
27,28 |
28,41 |
15,28 |
b.103 |
3,26 |
4,10 |
105,2 |
c'.10-5 |
0,502 |
-0,46 |
- |
c.106 |
- |
- |
-31,04 |
Изменение энтропии реакции в стандартных условиях:
![]() Дж/К
Дж/К
а = 15,28-28,41-2.27,28 = - 67,69
b = 105,2-4,10-2.3,26 = 94,58
с’=0,46-2.0,502 = -0,544
с = -31,04
Сp= -67,69+94,58.10-3.Т-0,544.105Т-2-31,04.10-6Т2


Пример 6.
Молярная теплоемкость
сероводорода (H2S)
равна Ср=29,4+0,0154.Т Дж/моль.К.
Вычислите молярную энтропию H2S
при 227С и давлении
2 атм., если
![]() Дж/моль.К.
Дж/моль.К.
Стандартная энтропия изменится на S при изобарическом нагревании и S при изотермическом сжатии.
Тогда:

