
- •Классификация направлений нт
- •Понятия самосборки и самоорганизации
- •Супрамолекулярная химия как направление нанотехнологии
- •Типы межмолекулярных взаимодействий
- •Структура белка
- •Четыре уровня структуры белка
- •Микроэлектромеханические и наноэлектромеханические системы (мэмс и нэмс)
- •Основной принцип работы акселерометров на пьезоэлементах
- •Биомиметика.
- •Размерные эффекты
- •Слабые эффекты
- •Сильные эффекты
- •Один из способов классификации нанообъектов
- •Понятие о наноэлектронике.
- •Физические основы наноэлектроники
- •Начальные элементы квантовой механики
- •Волновая функция. Уравнение Шредингера
- •Туннельный эффект.
- •Квантовое ограничение. Простейшие виды низкоразмерных объектов.
- •Простейшие виды низкоразмерных объектов
- •Энергетический спектр электронов и плотность электронных состояний в низкоразмерных объектах
- •Энергетический спектр 3d-электронного газа
- •Энергетический спектр 2d-электронного газа
- •Электронный газ в квантовой нити (1d-газ)
- •От микро- к наноэлектронике
- •Энергетический спектр кристалла
- •Лазеры на двойных гетероструктурах
- •Новые аллотропные модификации углерода: фуллерены и углеродные нанотрубки
- •Фуллерены
- •Углеродные нанотрубки
Новые аллотропные модификации углерода: фуллерены и углеродные нанотрубки
Уникальная природа углеродной связи позволяет углероду образовывать интересные и перспективные для нанотехнологий наноструктуры, например углеродные нанотрубки (УНТ).
Природа углеродной связи
Среди огромного числа известных сегодня молекул наибольшим разнообразием отличаются молекулы соединений углерода – органические. Уникальная особенность углерода состоит в том, что его атомы объединяются в цепочки повторяющихся звеньев различной длины. Атомы углерода, образующие органические соединения, могут находиться в трех структурных состояниях:
тетраэдрическое, в котором атом углерода находится как бы в центре тетраэдра, а его связи с другими атомами направлены к вершинам тетраэдра;
тригональное – связи атома углерода направлены от центра плоского треугольника к его вершинам;
линейное – все три атома - углерода и двух связанных с ним, лежат на одной прямой
Поскольку в подавляющем числе органических соединений валентность углерода равна четырем, тригональные состояния проявляются в молекулах с двойными связями углерод-углерод, а линейные – в молекулах с тройными связями.
Эти структурные особенности молекул соединений углерода могут быть объяснены, исходя из свойств их электронной структуры. Сегодня геометрическая конфигурация ядер сравнительно больших органических молекул может быть определена с точностью эксперимента решением уравнения Шредингера. Но это — трудоемкий и дорогостоящий путь. Поэтому еще в 30-е гг. прошлого века, когда расчетные квантовомеханические методы находились в зачаточном состоянии, известный химик-теоретик Полинг предложил полуэмпирический метод объяснения. Исходя из экспериментально установленных вариантов расположения связей атома углерода, он предложил в качестве объяснения принцип гибридизации атомных орбиталей.
Как известно, валентные электроны атома углерода находятся на атомных 2s- и 2р-орбиталях. 2s-орбитали имеют сферическую симметрию, а 2р-орбитали располагаются в пространстве перпендикулярно друг другу. Поскольку линейные комбинации решений уравнения Шредингера являются также его решениями, Полинг ввел понятие гибридных орбиталей — линейных комбинаций s- и р-орбиталей атома углерода. Если при этом наложить на эти комбинации симметрийные ограничения, то оказывается, что они правильно описывают пространственное расположение связей атома углерода. Учет симметрийных принципов показал, что в случае тетраэдрической симметрии во все четыре гибридные орбитали входят s- и все р-орбитали углерода. Этот вариант называют sр3-гибридизацией. Тригональные (sр2) и линейные (sр) гибридные орбитали в соответствии с симметрийными требованиями должны строиться из s- и двух р-, и s- и одной р-орбиталей соответственно. Т.о., остаются не вошедшие в гибридные – одна р-орбиталь в случае sр2-гибридизации и две р-орбитали в случае sр-гибридизации. Их перекрыванием Полинг объяснил образование двойных и тройных связей углерод–углерод.
Еще немного о концепции гибридизации.
Д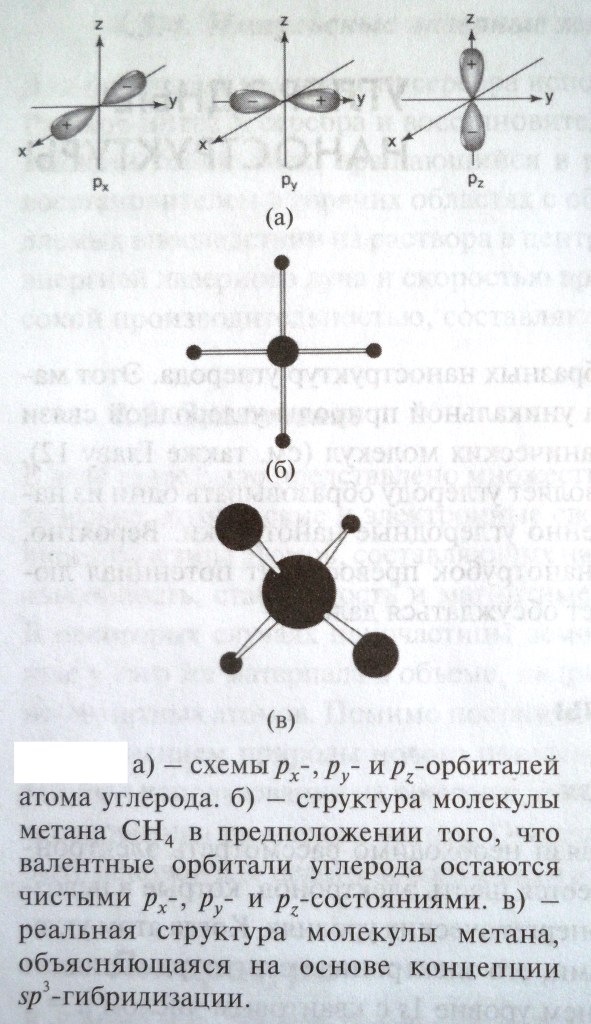 ля
понимания природы углеродной связи
необходимо рассмотреть электронную
структуру атома углерода. В нем имеется
шесть электронов, которые в невозбужденном
атоме находятся на низших энергетических
уровнях. Когда атом углерода связан
в молекуле с другими атомами, его
электронная структура выглядит так:
(1s)2, (2s), (2рх),
(2ру), (2pz). На
нижнем уровне 1s с квантовым числом
n = 1 находятся два
электрона с противоположно направленными
спинами. Распределение заряда
электрона в s-состоянии сферически
симметрично. Эти ls-электроны не
принимают участия в образовании
химических связей. Остальные четыре
электрона находятся на уровнях с n
= 2: один — на сферически симметричной
s-орбитали, три — на рх-,
ру- и pz
-орбиталях. Распределения заряда на
p-орбиталях имеют сильно удлиненную
в одном направлении форму и их оси
взаимно перпендикулярны (а).
Внешняя s-орбиталь и три p-орбитали
и формируют химические связи атома
углерода с другими атомами. Распределения
зарядов, связанных с этими орбиталями,
смешиваются, или другими словами,
перекрываются с распределениями зарядов
каждого связанного с углеродом атома.
Можно рассматривать облако электронного
заряда между двумя связанными атомами
как клей, сцепляющий эти атомы. На основе
таких упрощенных рассуждений молекула
метана (СН4) могла бы иметь вид,
показанный на рис. (б), где все связи
Н — С перпендикулярны друг другу. Однако
в действительности структура молекулы
метана не такая, а тетраэдрическая, с
углами между углеродными связями,
составляющими 109°28' (в). Этот факт
объясняет концепция гибридизации.
В атоме углерода разность энергий между
2s- и 2р- уровнями очень мала, что
позволяет волновым функциям 2s-состояния
смешиваться с одной или несколькими
волновыми функциями 2р-состояния.
Ненормализованная волновая функция Ψ
валентного состояния может быть
записана в виде:
ля
понимания природы углеродной связи
необходимо рассмотреть электронную
структуру атома углерода. В нем имеется
шесть электронов, которые в невозбужденном
атоме находятся на низших энергетических
уровнях. Когда атом углерода связан
в молекуле с другими атомами, его
электронная структура выглядит так:
(1s)2, (2s), (2рх),
(2ру), (2pz). На
нижнем уровне 1s с квантовым числом
n = 1 находятся два
электрона с противоположно направленными
спинами. Распределение заряда
электрона в s-состоянии сферически
симметрично. Эти ls-электроны не
принимают участия в образовании
химических связей. Остальные четыре
электрона находятся на уровнях с n
= 2: один — на сферически симметричной
s-орбитали, три — на рх-,
ру- и pz
-орбиталях. Распределения заряда на
p-орбиталях имеют сильно удлиненную
в одном направлении форму и их оси
взаимно перпендикулярны (а).
Внешняя s-орбиталь и три p-орбитали
и формируют химические связи атома
углерода с другими атомами. Распределения
зарядов, связанных с этими орбиталями,
смешиваются, или другими словами,
перекрываются с распределениями зарядов
каждого связанного с углеродом атома.
Можно рассматривать облако электронного
заряда между двумя связанными атомами
как клей, сцепляющий эти атомы. На основе
таких упрощенных рассуждений молекула
метана (СН4) могла бы иметь вид,
показанный на рис. (б), где все связи
Н — С перпендикулярны друг другу. Однако
в действительности структура молекулы
метана не такая, а тетраэдрическая, с
углами между углеродными связями,
составляющими 109°28' (в). Этот факт
объясняет концепция гибридизации.
В атоме углерода разность энергий между
2s- и 2р- уровнями очень мала, что
позволяет волновым функциям 2s-состояния
смешиваться с одной или несколькими
волновыми функциями 2р-состояния.
Ненормализованная волновая функция Ψ
валентного состояния может быть
записана в виде:
Ψ = s + p,
где р означает смесь pi орбиталей. При такой гибридизации направления лепестков р-орбиталей и угла между ними меняются. Углы зависят от относительного коэффициента смешивания р-состояний c s-состояниями. Для линейной структуры ацетилена (Н–С≡С–Н), планарной структуры этилена (Н2С=СН2) и тетраэдрической структуры метана (СН4) углы между связями составляют 180°, 120° и 109°28' соответственно. Обычно большинство углов между связями углерода в органических молекулах имеет именно эти значения. Например, угол углеродной связи в алмазе равен 109°, в графите и бензоле — 120°.
Твердый углерод имеет две основные формы, называемые аллотропными модификациями, — алмаз и графит. Они стабильны при комнатной температуре. Алмаз состоит из атомов углерода, тетраэдрически связанных друг с другом посредством sр3-гибридизированных связей, образующих трехмерную сетку. У каждого атома углерода – четыре ближайших соседа. Графит имеет слоистую структуру, причем каждый слой образован шестиугольниками из атомов углерода, связанных посредством sр2-гибридизированной связи, угол между которыми составляет 120°. У каждого атома углерода есть три ближайших соседа в плоскости слоя. Эти гексагональные слои связаны друг с другом относительно слабыми силами Ван дер Ваальса.
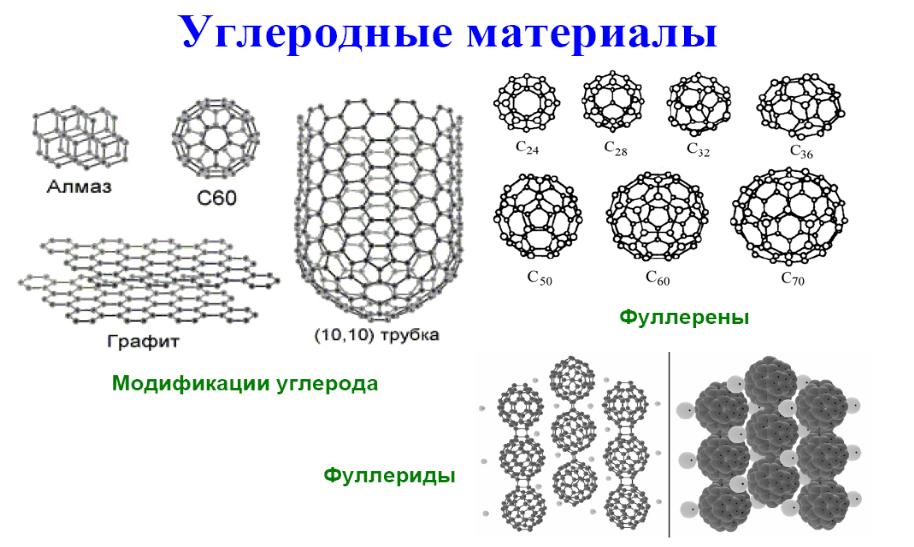
В полупроводниковой наноэлектронике и в нанотехнологии широко используются хорошо известные из интегральной электроники такие материалы как кремний, германий, их твердые растворы, соединения АIIIВV (GaAs, AlAs, GaP, InP и др.) и твердые растворы на их основе, соединения АIIВVI и многие другие, а также широко известные диэлектрические материалы и металлы. В последние годы появились новые перспективные для нанотехнологий углеродные нанообразования, такие как фуллерены, углеродные нанотрубки и графен. Очень интересные свойства и широкую перспективу применения имеют тонкие слои гибридных нанокомпозитов, полученные методом Ленгмюра-Блоджетт.
