- •1.Основні положення мкт та їх дослідне обґрунтування. Маса і розмір молекул. Стала Авогадро. Швидкість теплового руху молекул. Дослід Штерна.
- •2.Ідеальний газ. Основне рівняння мкт ідеального газу. Температура та її вимірювання. Шкала абсолютних температур.
- •3.Рівняння стану ідеального газу (рівняння Менделєєва-Клапейрона). Ізопроцеси в газах
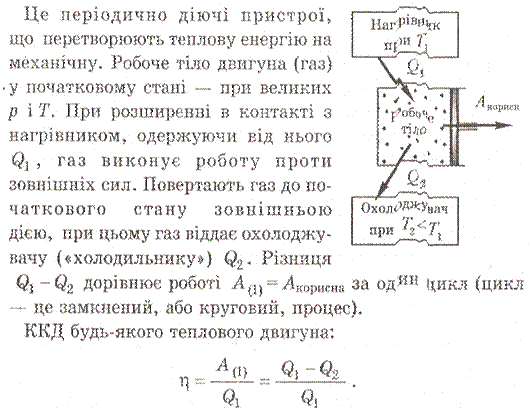
- •5.Необоротність теплових процесів. Принцип дії теплових двигунів. Ккд теплового двигуна і його максимальне значення. Теплові двигуни і проблеми охорони навколишнього середовища.
- •6.Пароутворювання (випаровування та кипіння). Конденсація. Питома теплота пароутворення. Насичена і ненасичена пара, їхні властивості. Вологость повітря та її вимірювання.
- •7.Плавлення і кристалізація тіл. Питома теплота плавлення. Птиома теплота згоряння палива. Рівняння теплового балансу для найпростіших теплових процесів.
- •8.Поверхневий натяг рідини. Сила поверхневого натягу. Змочування. Капілярні явища.
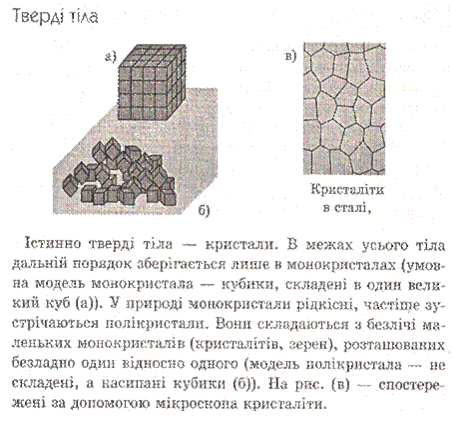
- •9.Кристалічні та аморфні тіла. Механічні властивості твердих тіл. Види деформації. Модуль Юнга.
5.Необоротність теплових процесів. Принцип дії теплових двигунів. Ккд теплового двигуна і його максимальне значення. Теплові двигуни і проблеми охорони навколишнього середовища.


6.Пароутворювання (випаровування та кипіння). Конденсація. Питома теплота пароутворення. Насичена і ненасичена пара, їхні властивості. Вологость повітря та її вимірювання.


Питома теплота пароутворення

Властивості пари: • тиск насиченої пари рідини при незмінній температурі - величина стала; • концентрація молекул насиченої пари у закритому обємі з рідиною завжди встановлюється при даній температурі одна і та сама незалежно від обєму, який займає пара; • тиск насиченої пари зростає з підвищенням температури.
Критична температура – температура Тк, при якій густини рідини і пари стають однаковими , при чому зникає межа розділу між рідиною і парою, перетворюється у нуль теплота пароутворення, пару і рідину не можна розрізнити. Стан, за якого відбувається це явище, називається критичним станом. Тиск насиченої пари рідини при її критичній температурі називають критичним тиском.
Для води, наприклад, критичний тиск дорівнює 2,2 . 107 Па (225,6 атм), для оксиду вуглецю СО2 – 7,35 . 106 Па (75 атм), а для гелію – всього 0,23. 106 Па (2,3,атм).
Об`єм, що його займає речовина у критичному стані називають критичним об`ємом.
Він відповідає найбільшому значенню обєму, який може займати дана маса речовини у рідкому стані

Пристрої для вимірювання вологості повітря: • психрометри; • гігрометри.
Психрометр складається з двох термометрів. Резервуар, що містить спирт, в одного з термометрів обгорнутий вологою тканиною, з якої випаровується вода, внаслідок чого відбувається охолодження спирту. Чим менш вологе повітря тим нижчу температуру показує термометр. За різницею показників термометрів з використанням психометричної таблиці визначають вологість повітря.
7.Плавлення і кристалізація тіл. Питома теплота плавлення. Птиома теплота згоряння палива. Рівняння теплового балансу для найпростіших теплових процесів.

Питома теплота плавлення

Питома теплота згоряння палива (теплотворна здатність)


8.Поверхневий натяг рідини. Сила поверхневого натягу. Змочування. Капілярні явища.
На молекулу В всередині рідини з усіх боків діють сусідні молекули, так що результуюча сила їх дії на дану молекулу дорівнює нулю. На молекулу А у поверхневому шарі сусідні молекули рідини діють сильніше, ніж молекули пари над рідиною. Результуюча сила відмінна від нуля і напрямлена всередину рідини. Тому існує тенденція рідини мати на межі з повітрям форму з найменшою поверхнею ( сферичну).
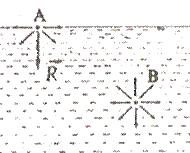
Сила, яка викликає скорочення вільної поверхні рідини, називається силою поверхневого натягу. Ця сила прямо пропорційна довжині контура, що обмежує вільну поверхню: FH ~l, FΗ = σl. Коефіцієнт пропорційності: σ = FH / l характеризує звязки між молекулами рідини і називається поверхневим натягом рідини: [σ] = H/м.

9.Кристалічні та аморфні тіла. Механічні властивості твердих тіл. Види деформації. Модуль Юнга.