
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ ФАРМАЦИЯ
.pdf
Амид сульфаниловой кислоты (стрептоцид) получают по следующей схеме:
|
|
|
NH2 (CH3CO)2O |
|
NHCOCH3 |
|
ClSO3H |
|
NHCOCH3 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
- HCl |
|
|
|
|
|
|
|||
|
|
|
-CH3COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
- H2SO4 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO3S |
|
|
|
|
|
|
||
|
|
|
|
NHCOCH3 |
|
|
|
|
|
|
|
NHCOCH3 |
|
|
|
|
NH2 |
|||||
O |
NH3 |
O |
|
|
H2O |
O |
||||||||||||||||
O |
|
|
S |
-HCI |
|
O |
|
|
S |
|
|
NaOH |
|
O |
|
|
S |
|||||
|
|
|
|
|
|
|
- CH3COONa |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
Cl |
|
|
|
|
|
NH2 |
|
|
|
|
NH2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Биологически активные производные аминобензолсульфокислот
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
NH-R/ |
|||||
|
|
|
O |
|
|
|
|
|
O |
||||||||||||||||||||||||||
|
|
O |
|
|
|
S |
|
|
|
|
|
O |
|
|
S |
||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
NHR |
||||||||||||||||||||
|
п-аминобензолсульфамид |
|
|
|
|
|
соединения ряда сульфаниламидов |
||||||||||||||||||||||||||||
|
стрептоцид, сульфаниламид |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
R=COCH3 |
R/=H |
альбуцид (сульфацетамид)(лечение коньюктивитов, гонореи, пневмонии) |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
R= |
|
N |
|
|
|
R/=H |
|
|
|
|
|
|
|
|
сульфометоксипиридазин (лечение мененгитов, лепры, пневмонии) |
||||||||||||||||||||
CH3O |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R= |
|
N |
|
|
|
R/=H |
|
|
|
|
сульфадиметоксин (лечение туберкулеза, малярии, гриппа, сифилиса) |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
CH3O |
N |
|
|
OCH3 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
фталазол (фталилсульфатиазол) |
|||||||
R= |
|
|
|
|
|
R/= |
( |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
NH2 |
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
лечение дизентерии, энтероколита) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сульфатиазол серебра (антибактериальное и ранозаживляющее действие) |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
( |
|
лечение ожогов, пролежней, трофических язв) |
|||||||||||||||||||||||||
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
SO2 N |
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
Ag |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
305

Все сульфаниламидные препараты обладают противомикробным действием. Эти соединения конкурируют с п-аминобензойной кислотой в синтезе фолиевой кислоты, необходимой для образования пуриновых и пиримидиновых оснований в клетках микроорганизмах, и тем самым останавливают рост и развитие микроорганизмов.
NH2
COOR
R=C2H5, н-C3H7, CH(CH3)2
R=C2H5, этил п-аминобензоат или анестезин, сложные эфиры ПАБК относятся к анестетикам.
NH2 COOR
R=CH3, C2H5, метил или этил о-аминобензоаты
сложные эфиры антраниловой кислоты входят в состав эфирных масел апельсинового дерева
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Это циклические соединения, в состав которых кроме атомов углерода и водорода входят другие, так называемые гетероатомы – N, O, S, P, Se и т.д. По программе курса мы рассматриваем синтез и реакционную способность наиболее важных гетероциклов, содержащих атомы N, O, S (пятичленные, шестичленные и некоторые конденсированные гетероциклы).
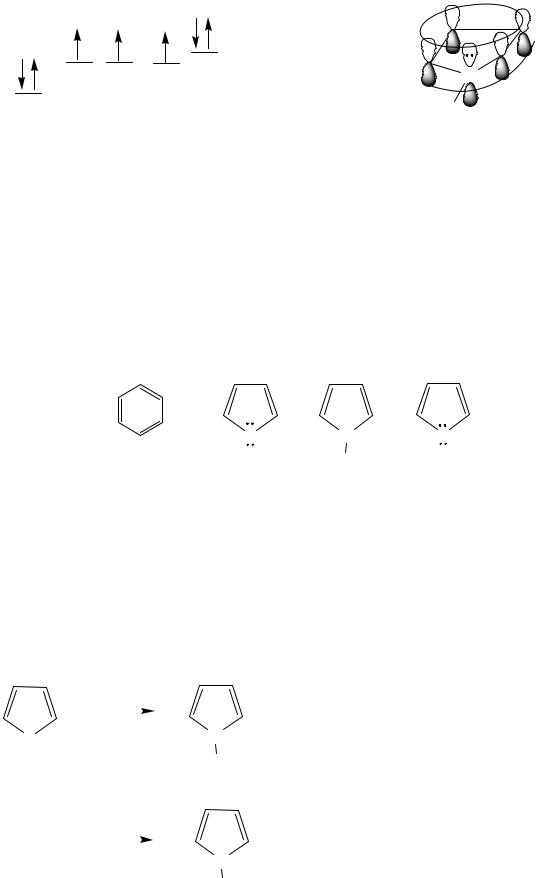
Пятичленные гетероциклы с одним гетероатомом (ГА)
Номенклатура
β/4 |
3 β |
β/ 4 |
3 β |
β/4 |
3 β |
α/ 5 |
2 α |
α/ 5 |
2 α |
α/ 5 |
2 α |
|
N 1 |
|
O 1 |
|
S 1 |
|
H |
|
|
|
|
пиррол |
|
фуран |
|
тиофен |
|
Строение
Все три цикла относятся к ароматическим. Атомы углерода, азота, кислорода, серы находятся в sp2-гибридизации, ароматический секстет электронов составлен из 4р-ēат.С и 2р-ēГА (см. также тему “Арены, критерии ароматичности”). Ароматические системы этих гетероциклов относятся к π- избыточным, т.к. на 5 атомов цикла приходится 6р-ē.
306
Модель молекулы пиррола
распределение электронов для атома N в sp2 - гибридизации
|
pz |
2sp2 |
N |
1s |
H |
Аналогично устроены молекулы фурана и тиофена.
Реакционная способность
Являясь ароматическими системами, пятичленные гетероциклы вступают преимущественно в реакции электрофильного замещения в специфических условиях. Их реакционная способность значительно выше реакционной способности бензола, причиной является π-избыточность этих гетероциклов. Примерный ряд изменения реакционной способности коррелируются с электроотрицательностью гетероатома (чем выше эта величина, тем выше реакционная способность гетероцикла).
< |
< |
< |
S |
N |
O |
|
H |
|
Пиррол
Пиррол представляет собой бесцветное масло, легко окисляющееся при стоянии. Для производных пиррола характерно красное окрашивание сосновой палочки, смоченной конц. HCl.
|
|
|
|
|
Методы получения |
|
1. |
|
NH3 |
+ H2O (реакция Юрьева) |
|||
|
|
|
|
|||
Al2O3, 4000C |
||||||
O |
N |
|||||
|
|
|
|
|
H |
|
2. 2 H-C≡C-H |
|
NH3 |
|
+ H2 |
||
|
Fe2O3 |
|||||
|
|
N |
||||
|
|
|
|
|
H |
|
307
Реакционная способность
Для пиррола характерны реакции электрофильного замещения, SEAr, протекающие в особых условиях и преимущественно по α-положению. Пиррол проявляет также свойства NH-кислоты.
I. Кислотно-осно́вныесвойства |
пиррола |
|
Пиррол является слабой |
NH-кислотой, рКаN-H 3.8, |
и способен |
реагировать со щелочными металлами и сильными основаниями. |
|
|
|
CH3MgI |
|
|
Na |
+ H2 |
(NH3) |
|
- CH4 |
|
|
|
||
N |
|
N |
или NaH, NaNH2 N |
|
||
MgI |
|
|
H |
|
Na |
|
N-магнийиодидпиррол |
K |
- H2 |
|
пирролат натрия |
||
|
|
|
||||
N
K
пирролат калия
Пирролат калия используют для получения 1- и 2-алкилпирролов по следующей схеме:
|
CH3I |
|
|
|
|
N |
- KI |
N |
0 |
N |
CH3 |
|
50 C |
||||
K |
|
CH3 |
|
H |
|
|
|
1-метилпиррол |
|
2-метилпиррол |
|
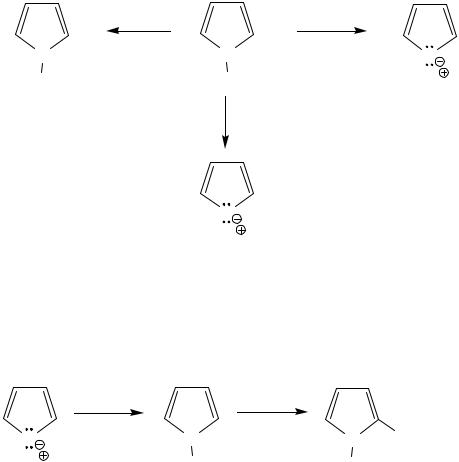
Осно́вные свойства атома азота пиррола практически отсутствуют за счет включения его неподеленной пары электронов в ароматический секстет, но пиррол способен протонироваться по положениям 1,2,3, образующиеся при этом катионы далее полимеризуются. Это свойство разрушаться под действием минеральных кислот называется ацидофобностью.
308
|
H |
|
|
H |
|
|
H |
|
H |
полимеризация после |
|
|
|
|
|||
|
|
|
|
|
разрыва С-С связей |
N |
N |
H |
N |
N |
|
H |
H |
|
H H |
H |
|
Следствием ацидофобности является недопустимость ведения реакций пиррола в кислой среде.
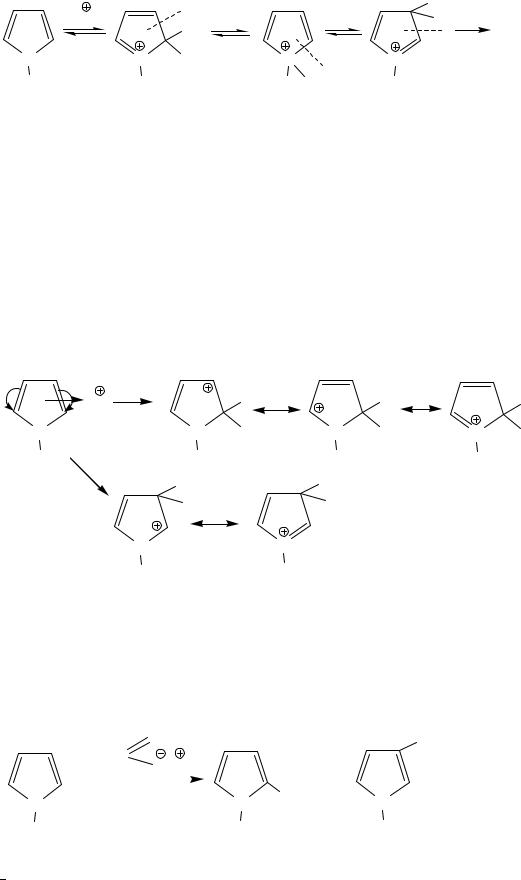
II. Реакции электрофильного замещения, SEAr
Молекула пиррола поляризована в сторону более электроотрицательного атома азота. Из двух возможных σ-комплексов (α или β), образующихся после атаки электрофила, более устойчивым является α-,σ-комплекс, и реакции идут преимущественно по α-положению (если это положение занято, то по α′ или β).
Механизм, SEAr (общее описание)
|
|
α |
H |
|
H |
|
H |
|
E |
|
|
|
|||
N |
|
N |
E |
N |
E |
N |
E |
H |
β |
H |
|
H |
|
H |
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
||
|
|
E |
|
E |
|
|
|
|
|
N |
|
N |
|
|
|
|
|
H |
|
H |
|
|
|
α-σ-Комплекс, описываемый с помощью трех резонансных структур более стабилен и образуется преимущественно.
1. Нитрование
|
CH3C |
O |
|
|
NO2 |
|
O NO2 |
|
+ |
||
|
|
|
|||
|
(CH3CO)2O |
|
ΝΟ2 |
||
N |
N |
N |
|||
H |
- 100C |
|
H |
|
H |
-CH3COOH |
|
||||
|
2(α)-нитропиррол |
3(β)-нитропиррол |
|||
|
|
|
51% |
|
13% |
309
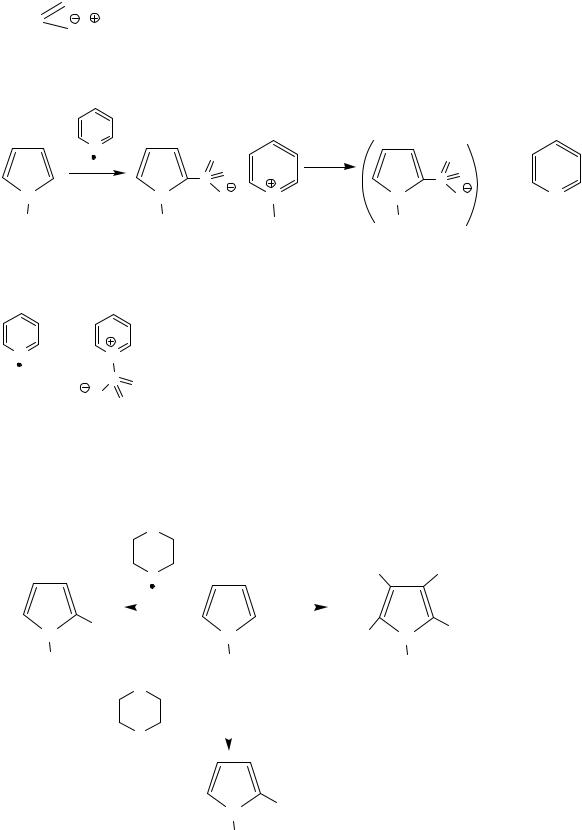
CH3C |
O |
ацетилнитрат, мягкий нитрующий агент |
|
|
O NO2 |
2. Сульфирование
N |
O |
|
Ba(OH)2 |
O |
|
|
|
SO3 |
S |
O |
|
|
S O |
Ba + |
+ H2O |
|
|
|
|||||
N |
N |
O |
N |
N |
O |
2 |
N |
H |
H |
|
H |
H |
|
|
|
|
|
|
|
бариевая соль |
|
|
|
|
|
|
|
2-пирролсульфокислоты |
|
||
или |
|
пиридинсульфотриоксид или 1-пиридиний сульфонат, |
N |
N |
мягкий сульфирующий агент |
|
||
SO3 |
S O |
|
O |
|
|
O |
|
Пирролсульфокислоты неустойчивы, поэтому их выделяют в виде солей.
3. Галоидирование
|
|
|
O |
|
|
|
|
|
|
|
|
|
1) |
|
|
|
|
|
|
|
|
|
Br |
|
|
|
O |
|
|
|
|
Br |
|
||
|
|
|
Br2 |
|
|
|
|
изб. Br2 |
|
+ 4 HBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
Br |
2) NaOH |
N |
|
этанол Br |
N |
Br |
||||
H |
- NaBr |
H |
|
|
|
H |
|
||||
-H2O |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||
2(α)-бромпиррол |
O |
|
|
|
|
2,3,4,5-тетрабромпиррол |
|||||
|
|
|
|
||||||||
|
- |
|
|
|
|
|
SO2Cl2 |
|
|
||
|
|
O |
|
|
|
|
|
|
|
||
|
диоксан |
|
|
|
+ SO2 + HCl |
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
N |
|
Cl |
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
2(α)-хлорпиррол |
|
|
||||
310
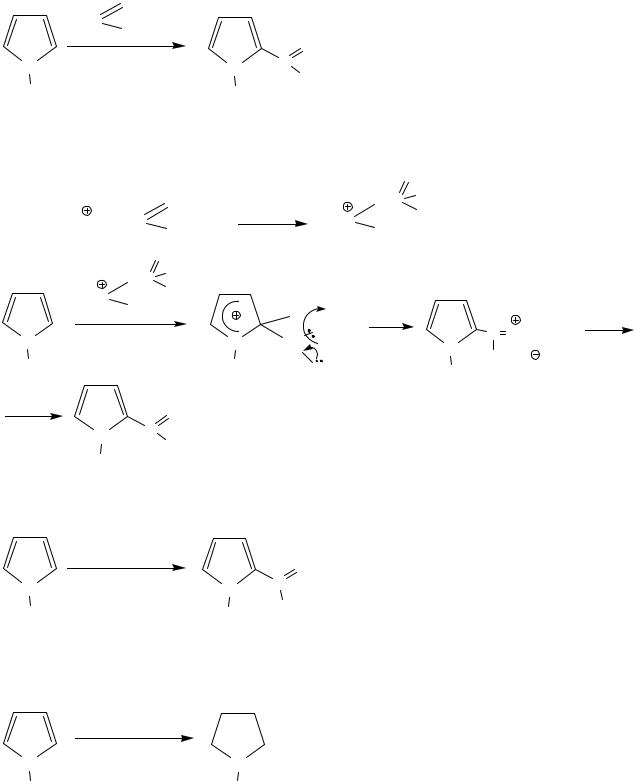
4. Формилирование, ацетилирование
а) Реакция Вильмейера-Хаака
|
H-C |
O |
|
|
|
N(CH3)2 |
|
|
|
|
|
|
O |
|
|
|
|
|
|
N |
POCl3 |
N |
C |
|
H |
|
|
H |
H |
|
|
|
||
2(α)-формилпиррол
Механизм, SEAr
|
|
|
|
|
|
|
|
O |
Cl |
|
|
|
|
|
|
O |
|
POCl3 |
|
O-P |
|
|
|
генерация Е : H-C |
|
|
H-C |
Cl |
|
|
|||||
|
N(CH3)2 |
|
N(CH3)2 |
|
|
||||||
|
|
|
O |
|
|
|
|
||||
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
O-P |
|
|
|
|
|
|
|
||
|
H-C |
|
|
Cl |
|
|
|
|
|
|
|
|
N(CH3)2 |
|
H |
|
|
|
|
NaOH |
|||
|
|
|
OPOCl2 |
|
|
|
|||||
N |
|
|
|
|
N |
CH |
- PO2Cl |
N |
C N(CH ) |
||
|
|
|
|
|
|
3 2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
H |
|
N(CH3)2 |
|
H |
H |
Cl |
|
|
|
|
|
|
|
|||||
|
N |
|
C |
O |
+ NaCl + HN(CH3)2 |
|
|
|
|
||
|
|
H |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) Ацетилирование |
|
|
|
|
|
|
|
|
|||
|
(CH3CO)2O |
|
|
O |
|
|
|
|
|
||
|
1500C |
|
|
|
|
|
|
|
|
||
N |
|
|
N |
C |
|
|
|
|
|
||
- CH3COOH |
|
CH3 |
|
|
|
|
|
||||
H |
|
H |
|
|
|
|
|
||||
|
|
|
|
|
2(α)-ацетилпиррол |
|
|
|
|
||
III. Реакции присоединения (гидрирование) |
|
|
|
||||||||
|
2H2/ Pt |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
N |
|
|
|
|
|
|
H |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
2,3,4,5-тетрагидропиррол, |
|
|
|
|
||||
|
|
|
|
|
пирролидин |
|
|
|
|
|
|
311
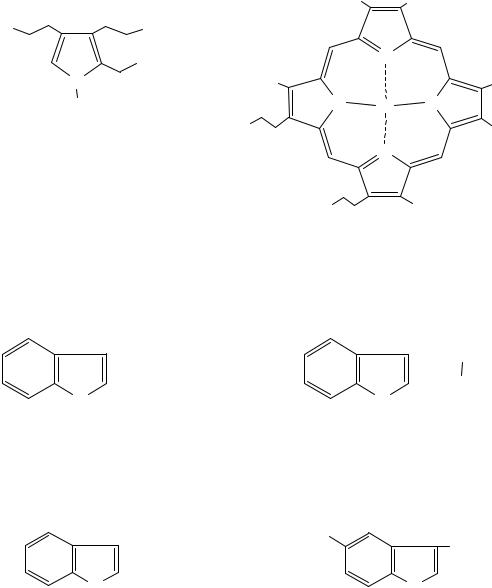
Биологические свойства производных пиррола
Пиррол является родоначальником обширного класса соединений, относящихся к порфиринам, - это гемоглобин, хлорофилл, билирубин (красящее вещество желчи). В живой клетке эти пигменты синтезируются из порфобилиногена, участвующего в процессе основного метаболизма.
|
CH3 |
|
CH=CH2 |
HO |
COOH |
|
|
N |
NH2 |
N |
|
CH3 |
|
CH3 |
|
H |
N |
Fe |
N |
порфобилиноген |
HOOC |
N |
CH=CH2 |
|
|
|
|
|
HOOC |
|
гем крови |
|
|
CH3 |
К биологически важным конденсированным производным пиррола относится бензо[b]пиррол – индол. Существует обширная химия производных индола. Ниже приводятся некоторые биогенные его производные.
4 |
|
|
|
|
|
|
|
|
|
|
|
β |
α |
|
|
|
|
|
|
|
|
|
|
|
|
||
5 |
b |
3 |
|
|
|
|
|
|
CH2-CH-COOH |
||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
NH2 |
||
6 |
a N |
2 |
|
|
N |
||||||||
7 |
1 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|||||
|
бензо[b]пиррол, |
3-(3-индолил)-2-аминопропановая кислота, |
|||||||||||
|
индол |
|
|
|
|
|
триптофан ( Tr) |
|
|||||
|
|
|
|
|
|
|
(одна из незаменимых аминокислот) |
||||||
|
|
|
|
|
|
β α |
HO |
|
|
|
|
β |
α |
|
|
|
|
|
|
CH2-CH2NH2 |
|
|
|
|
CH2-CH2NH2 |
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
N |
|
|
|
N |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
|||||
2-(3-индолил)этиламин, |
2-(5-окси-3-индолил)этиламин, |
||||||||||||
|
триптамин |
|
|
серотонин |
|||||||||
(эндогенный амин, образуется при |
|
(нейромедиатор) |
|||||||||||
декарбоксилировании триптофана) |
|
|
|
|
|
|
|
||||||
312
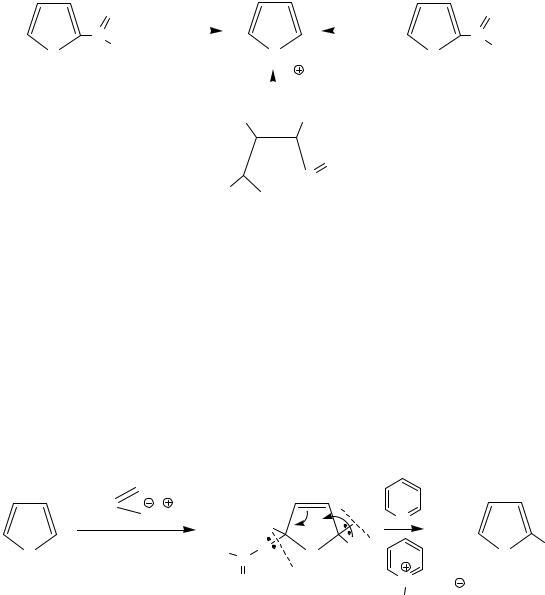
Фуран
Представляет собой бесцветное масло, легко окисляется при стоянии. Для фурана и его производных характерно зеленое окрашивание сосновых палочек, смоченных конц.HCl.
Методы получения
|
O |
|
4000C/ H2O |
|
|
|
Cu |
O |
|
C |
|
|
|
|
|
C OH |
|||
|
|
|
|
|
|
|
|
||
H |
- Zn(CrO4)2 |
O |
2000C |
||||||
O |
|
|
- CO |
|
- CO2 |
O |
|||
2(α)-формилфуран, |
|
|
H |
2(α)-фуранкарбоновая кислота, |
|||||
|
|
||||||||
фурфурол |
|
|
|
|
|
|
t0C |
пирослизевая |
|
|
|
|
|
HO |
|
|
OH |
|
|
O
C 
HO CH2OH H
альдопентозы
Реакционная способность
Для фурана характерна двойственная реакционная способность, фуран вступает в реакции электрофильного замещения, SEAr преимущественно по α- положению (аналогично пирролу) и электрофильного присоединения, AdE (в качестве сопряженного диена). Фуран, как и пиррол ацидофобен.
1. Нитрование
|
CH3C |
O |
|
|
|
|
|
|
|
|
|
|
O NO2 |
|
H |
|
H |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
||||
O |
(CH3CO)2O |
CH3 C |
O |
O |
NO |
2- |
|
O |
NO |
2 |
|
- 100C |
|
|
|
|
|||||||
|
O |
|
|
|
|
N |
2(α)-нитрофуран |
||||
H CH3COO
На первой стадии нитрования образуется продукт 1,4-присоединения реагента (проявление свойств сопряженного диена). Далее чтобы получить α- нитрофуран, необходимо элиминировать уксусную кислоту с помощью основания (пиридина).
Механизм 1-ой стадии нитрования, AdE
313
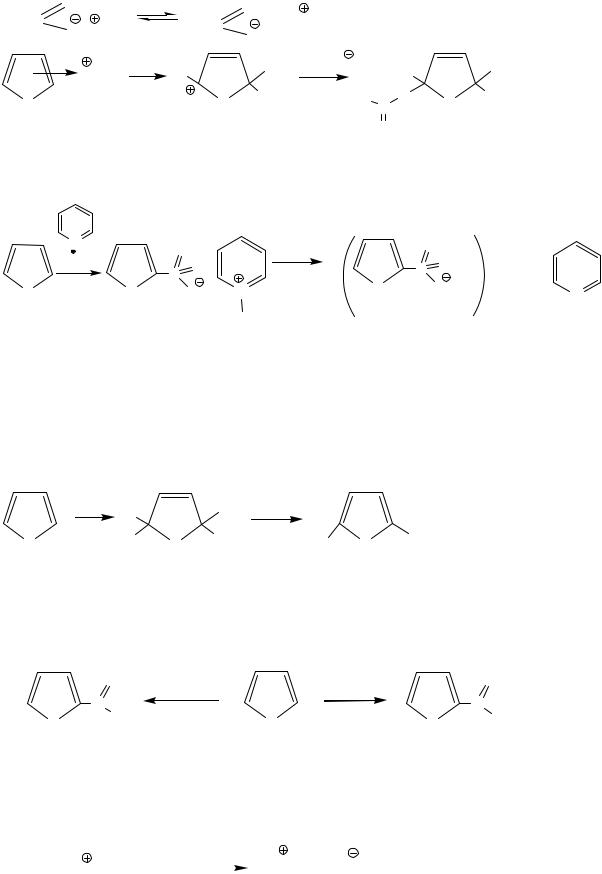
|
O |
|
O |
|
|
|
CH3C |
O NO2 |
CH3C |
+ NO2 |
|
|
|
|
|
O |
|
|
|
|
|
NO2 |
H |
H |
CH3COO |
H |
H |
|
|
|
|
|||
O |
|
O |
NO2 |
CH3 C O |
O -NO2- |
|
π-комплекс |
σ-комплекс |
|
O |
|
||
|
|
|
|
|
|
|
2. Сульфирование
|
N |
|
O |
|
BaCO3 |
|
|
O |
|
|
SO3 |
S |
O |
|
|
|
S |
O |
Ba + |
|
|
|
- CO2 |
O |
O |
||||
O |
|
O |
O |
N |
|
N |
|||
|
- H2O |
|
|
|
|||||
|
|
|
|
H |
бариевая соль |
2 |
|||
|
|
|
|
|
|||||
2-фурансульфокислоты
Сульфокислоты фуранового ряда также неустойчивы, как и кислоты ряда пиррола.
3. Галоидирование
|
Cl2 |
H |
|
H |
Cl2 |
|
|
|
|
|
|
|
- 2 HCl |
|
|
|
|
O |
- 400C Cl |
O |
Cl |
Cl |
O |
Cl |
||
|
|
|
|
|
||||
2,5-дихлорфуран
4. Формилирование, ацетилирование
|
O |
1) H-C≡N, HCl |
|
CH3COCl |
|
O |
|
|
сух. газы |
|
|
||||
|
C |
2) H2O |
|
SnCl |
|
C |
|
O |
H |
O |
O |
CH3 |
|||
- HCl4 |
|||||||
2(α)-формилфуран, |
|
|
2(α)-ацетилфуран |
||||
фурфурол |
|
|
|
|
|
|
|
Механизм формилирования, SEAr
генерация Е : H-C≡N |
HCl |
H-C=NH Cl |
|
314
