
- •7 Вопрос.
- •Вопрос № 9. Роль воды в процессах жизнедеятельности человека
- •10. Понятие об идеальном растворе. Константа растворимости. Условия растворения и образования осадков.
- •Вопрос 11
- •Второй закон Рауля
- •Осмотическое давление
- •Растворы электролитов
- •Изоосмия
- •Вопрос 12
- •Автопротолиз как кислотно-основное взаимодействие
- •Константа автопротолиза
- •Автопротолиз воды
- •Вопрос 19.
Вопрос 1. Основные понятия термодинамики. Интенсивные и экстенсивные свойства системы. Внутренняя энергия. Работа и теплота – две формы передачи энергии. Типы термодинамических систем и процессов.
Основные понятия термодинамики:Термодинам-я система-это отдел-е тело или группа тел факт-ки или мыс-но отдел-х от окр.среды.
Экстен-е сво-во с-мы прямо проп-но массе сис-ы и обладает аддитивностью(можно складывать):V,H,Uвн,S,G,F. Интенсивное-не зависит от массы си-мы и не обладает сво-вом аддитивности:Q,A,T,P.Термодинам-й процесс-переход си-мы из одного сост-я в др-е,сопр-ся изм-ем параметров. Внутр.энергия(U) – сумма всех кин-их и потен-ых составляющих сис-мы.(мах).2 формы передачи энергии:Упоряд-ая форму передачи энергии-работа;Неупоряд-я-теплота.Типы термод-их си-ем:Изолир-ая-сис-ма,к-я не обменивается с окр.средой ни массой, ни энергией.Закр-ая-не обменивается с опр-ой средой массой, но обменивается энергией(термос).Откр-ая-обменивается массой и энергией с окр.средой.Типы термод-их процессов:Если Т=const, то ∆U=0 и ∆H=A – изотермический процесс. (внут.энергия не изменяется)Если ∆H=0, ∆U=-А и -∆U=А – адиабатический процесс. (работа производится за счет изменения внут.энергии системы)
Если А=0 (р∆V=0), то ∆H=∆U, Qv=∆U – изохорный процесс. (все тепло идет на изменение внутренней энергии, работы нет) Если p=const - изобарный процесс.
Вопрос 2. Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования, стандартная энтальпия сгорания. Закон Гесса. Термохимические процессы. Применение первого начала термодинамики к биосистемам. Примеры экзэргонических и эндэргонических процессов, протекающих в организме.
Первое начало термодинамики: (По своему существу первое начало термодинамики представляет собой закон сохранения и превращения энергии)
-
Энергия не создается и не уничтожается, возможно лишь превращение из одного вида в другой.
-
Вечный двигатель первого рода невозможен, т.е невозможно создать такой двигатель, который совершил бы работу без затраты энергии.
-
Внутренняя энергия изолированной системы есть величина постоянная.
Уравнение: Q=∆U+W (Q=∆U+p∆V)
Энтальпия – это то количество тепловой энергии, которое выделяется или поглощается при протекании процесса в условиях постоянства t и p(изобара) или t и V(изохора).
∆Н0хр=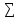 vj∆H0f(продуктов)
-
vj∆H0f(продуктов)
-
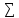 vi∆H0f(исх.вв)
vi∆H0f(исх.вв)
Стандартная энтальпия образования вещества (∆H0f) – изменение (уменьшение или увеличение) энтальпии, сопровождающее образование 1 моль вещества в стандартных условиях из простых веществ, взятых в устойчивых модификациях.
Стандартная энтальпия сгорания вещества (∆Н0с) равна уменьшению энтальпии при окислении в избытке кислорода 1 моль вещества, взятого в стандартном состоянии, до конечных продуктов окисления: оксида углерода(IV), воды, азота, оксида серы(IV).
Закон Гесса:
Теплота химической реакции , протекающей при постоянном объеме (или постоянном давлении) определяется только природой исходных веществ и продуктов реакции и не зависит от числа и последовательности промежуточных стадий, при условии, что теплоты измерены при одинаковой t.
Следствия из закона Гесса:
1. энтальпия образования любого соединения из простых веществ равна энтальпии его разложения на эти же вещества, но в обратным знаком ∆Н0обр= -∆Н0разл
2.
энтальпия химической реакции равна
разности сумм энтальпии образования
продуктов реакции и исходных веществ
∆Н0хр=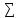 vi∆H0f(продуктов)
-
vi∆H0f(продуктов)
-
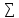 vj∆H0f(исх.вв)
vj∆H0f(исх.вв)
3.
энтальпия химической реакции равна
разности сумм энтальпии сгорания
продуктов реакции и исходных веществ
∆Н0хр=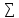 vi∆H0с(продуктов)
-
vi∆H0с(продуктов)
-
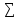 vj∆H0с(исх.вв)
vj∆H0с(исх.вв)
4.
свободная энергия реакции равна разности
сумм свободной энергии продуктов и
исходных веществ ∆G0р=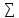 vi∆G0обр(продуктов)
-
vi∆G0обр(продуктов)
-
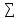 vj∆G0(исх.вв)
vj∆G0(исх.вв)
5.энтропия
реакции ∆S0р=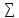 viS0обр(продуктов)
-
viS0обр(продуктов)
-
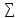 vjS0(исх.вв)
vjS0(исх.вв)
Термохимические процессы – переход системы из одного состояния в другое, сопровождающееся изменением параметров.
Применение первого начала термодинамики к биосистемам.
В 19 столетии было доказано экспериментально, что первый закон термодинамики применим к процессам, которые происходят в биологических системах.
Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Энергия высвобождается из пищевых продуктов в процессе их биологического окисления, которое является многоступенчатым процессом. Энергия пищевых продуктов используется в клетках первоначально для синтеза макроэргических соединений - например, аденозинтрифосфорной кислоты (ATФ). ATФ, в свою очередь, может использоваться как источник энергии почти для всех процессов в клетке.
Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма. Например, углеводы окисляются в организме до углекислого газа и воды. Такие же конечные продукты образуются при сжигании углеводов в калориметре:
C6H12O6 + 6O2 = 6CO2 + 6H2O
Величина энергии, высвобождаемой из каждого грамма глюкозы в этой реакции, составляет 4,1 килокалории (кКал). Столько же энергии, образуется при окислении глюкозы в живых клетках, несмотря на то, что процесс окисления в них является многоступенчатым процессом и происходит в несколько стадий. Этот вывод основан на принципе Гесса, который является следствием первого закона термодинамики: тепловой эффект многоступенчатого химического процесса не зависит от его промежуточных этапов, а определяется лишь начальным и конечным состояниями системы.
Таким образом, исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1грамме трех пищевых продуктов (в килокалориях): углеводы - 4,1; белки - 4,1; жиры - 9,3.
С другой стороны, в конечном итоге вся энергия, поступившая в организм, превращается в теплоту. Также при образовании АТФ лишь часть энергии запасается, большая - рассеивается в форме тепла. При использовании энергии ATФ функциональными системами организма большая часть этой энергии также переходит в тепловую.
Оставшаяся часть энергии в клетках идёт на выполнении ими функции, однако, в конечном счёте, превращается в теплоту. Например, энергия, используемая мышечными клетками, расходуется на преодоление вязкости мышцы и других тканей. Вязкое перемещение вызывает трение, что приводит к образованию тепла.
Другим примером является расход энергии, передаваемой сокращающимся сердцем крови. При течении крови по сосудам вся энергия превращается в тепло вследствие трения между слоями крови и между кровью и стенками сосудов.
Следовательно, по существу вся энергия, потраченная организмом, в конечном счете, преобразуется в теплоту. Из этого принципа существует лишь единственное исключение: в случае, когда мышцы выполняют работу над внешними телами.
Если человек не выполняет внешней работы, то уровень высвобождения организмом энергии можно определить по величине общего количества теплоты, выделенной телом. Для этого применяют метод прямой калориметрии, для реализации которого используют большой, специально оборудованный калориметр. Организм помещают в специальную камеру, которая хорошо изолирована от среды, то есть не происходит обмена энергией с окружающей камеру средой. Количество теплоты, выделенной исследуемым организмом, можно точно измерить. Эксперименты, выполненные этим методом, показали, что количество энергии, поступающей в организм, равно энергии, выделяющейся при проведении калориметрии.
Прямая калориметрия в проведении трудоёмка, поэтому в настоящее время используют метод непрямой калориметрии, который основан на вычислении энергетического выхода организма по использованию им кислорода.
Примеры экзэргонических и эндэргонических процессов, протекающих в организме.
Термические реакции, при протекании которых происходит уменьшение энергии Г(dG<0) и совершается работа называются ЭКЗЕРГОНИЧЕСКИМИ(окисление глюкозы дикислородом- C6H12O6+6O2=6CO2+6H2O, dG=-2880 кДж/моль! Реакции в результате которых энергия Г возрастает (dG>0) и над системой совершается работа, наз-ся ЭНДЕРГОНИЧЕСКИМИ!
7 Вопрос.
Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
-
Диффузия реагирующих веществ к поверхности твердого вещества
-
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
-
Химическая реакция между реагирующими молекулами
-
Десорбция продуктов с поверхности катализатора
-
Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Вопрос № 8
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
![]() ,
,
∆H = -46,2 кДж / моль
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции - выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
Обратимые реакции не доходят до конца и заканчиваются установлением химическою равновесия. Например, в реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно,
химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. И поскольку действиеобеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ - как исходных, так и образующихся -остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными.Они обычно обозначаются формулами реагирующих веществ, заключенными в квадратные скобки, например [Н2], [N2], [NH3], тогда как неравновесные концентрации обозначают так:
CH2, CN2, CNH3.
На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ - и давление.При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие,но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом)химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия в сторону продуктов реакции.Если же увеличивается концентрация исходных веществ, то равновесие смещается в сторону их образования.
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры.
