
- •1.Кровь:определение понятие,клеточный состав,его содержание в %.Плазма и сыворотка крови:понятие,методы получения,функции крови.
- •4.Альбумины сыворотки крови:место биосинтеза,особенности состав,структуры,физико-химических свойств,функций.
- •5.Белки острой фазы воспаления:d1-антитрипсин,2d-макроглобулин,гаптоглобулин,с-реактивный белок-механизмы повышения их уровня в крови при воспалении,диагностическое значение.
- •6.Иммуноглобулины:классификация,общая структура,место биосинтеза,функции,диагностическое значение.Понятие о белках системы комплемента.
- •7.Остаточный азот:понятие,состав,физиологическая роль и клиннико-диагностическое значение.
- •9.Ферменты плазмы крови:классификация,использование в энзимдиагностике.
- •Биохимия форменных элементов крови.
- •2.Особенности метаболизма веществ в эритроците:обмен метгемоглобина,связь с гликолизом.
- •3.Механизмы свободно-радикального окисления(сро) и антиоксидантная защита в эритроцитах(аоз).Самый еб*утый вопрос,надеюсь он никому не попадется)
- •4.Гемоглобин строение,функции,типы.Талассемии.Миоглобин:строение,функции,отличие от гемоглобина.
- •5.Биосинтез гема в организме человека:локализация,субстраты,ферменты,этапы и регуляция.Порфирин.
- •6.Связывание гемоглобина с кислородом(тритерный механизм),кооператорный аллостерический эффект.Кривая насыщения гемоглобина и миоглобина кислородом.
- •7.Сродство гемоглобина к кислороду и его регуляции(эффект Бора,влияние 2,3-дифосфоглицерата).
- •8.Транспорт углекислого газа эритроцитом.
- •9.Лейкоцит:функции,химический состав,особенности обмена веществ.Биохимические аспекты фагоцитоза.
- •Свертывающие и противосвертывающие системы крови.Фибринолиз
- •2.Функции сосудистого эндотелия,субэндотелия и тромбоцитов.
- •3.Первичный сосудисто-тромбоцитарный гемостаз.Участие тромбоксана и простоциклина в регуляции первичного гемостаза.
- •4.Понятие о синдроме диссеминированного внутрисосудистого свертывания(двс-синдром):причины,стадии,биохимические аспекты лечения.
- •5.Вторичный плазменный (коагуляционный) гоместаз:внутрений и внешней механизм свертывания.Взаимодействия внешнего и внутренного механизма свертывания.
- •7.Наследственные гемофилии:причины,принципы лечения.
- •8.Такой же как и 4,хз почему 2 раза,ах да это же 7 этаж,пережить и сдать,забыть как страшный сон,но память все равно останется)
- •1.Системный гомеостаз железа в организме человека этапы обмена,основные клетки,принимающие участие в обмене железа,суточные нормы и источники железа.
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •2.Виды железа,поступающего с пищей и особенности его всасывания в тонком кишечнике.
- •3.Метаболизм железа в энтерецитах,характеристика основных белков и ферментных систем,судьба всосавшегося железа в энтерцитах в зависимости от концентрации железа в крови.
- •6.Контроль поступления железа в кровь из кишечника и макрофагов:роль гепсидина,факторы,влияющие на его синтез.
- •7.Регуляция обмена железа в организме человека:система ire/irPи ее роль в синтезе апоферритина и рецепторов трансферина на уровне трансляции этих белков.
- •3. Ферритин и гемосидерин внутренних органов;
- •9.Нарушение обмена железа:биохимические основы развития жледезофицитной анемии и гемохроматоза.
4.Альбумины сыворотки крови:место биосинтеза,особенности состав,структуры,физико-химических свойств,функций.
Альбумин - белок плазмы крови
Глобулярный белок плазмы крови, синтезируется исключительно в печени. Хотя по классификации его относят к простым белкам, отмечается широкая микрогетерогенность молекул альбумина, что связано с количеством и качеством агрегированных с альбумином молекул.
Значение альбумина в плазме крови заключается:
1. В поддержании коллоидно-осмотического (онкотического) давления крови (благодаря высокой гидрофильности);
2. Транспортная – благодаря большому количеству заряженных и гидрофобных участков альбумин переносит
-
пигменты – (билирубин), одна молекула альбумина может одновременно связать 25-50 молекул билирубина,
-
длинноцепочечные жирные кислоты – основная физиологическая функция, 6-8 штук на одну молекулу альбумина,
-
катионы (например, Ca2+ и Mg2+) благодаря большому количеству глутамата, другие металлы (Hg+) также способен связать анионы (Cl–),
-
соли желчных кислот,
-
витамины,
-
гормоны (альдостерон, прогестерон, гидрокортизон),
-
органические красители,
-
лекарственные вещества (дигоксин, барбитураты, пенициллин, ацетилсалициловая кислота, сердечные гликозиды).
Изменения количества белка в крови могут иметь как абсолютный (истинный), так и относительный характер. Сдвиги абсолютного характера являются следствием колебаний содержания белка в крови. В свою очередь, относительные изменения зависят от объема крови, т.е. наблюдаются при обезвоживании или гипергидратации.
5.Белки острой фазы воспаления:d1-антитрипсин,2d-макроглобулин,гаптоглобулин,с-реактивный белок-механизмы повышения их уровня в крови при воспалении,диагностическое значение.
Белки острой фазы – большая группа белков сыворотки крови (в основном α-глобулинов) с молекулярной массой от 12 кДа до 340 кДа и различными функциями, объединенных по общему признаку – быстрое и значительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественных новообразованиях.
Синтез белков острой фазы осуществляется печенью, моноцитами, лимфоцитами, нейтрофилами. Их концентрация зависят от стадии заболевания и/или от масштабов повреждений. Синтез белков включается и регулируется рядом медиаторов, среди которых цитокины, анафилотоксины и глюкокортикоиды. Увеличение концентрации белков острой фазы в крови является хорошим индикатором не только явного, но и скрытого воспаления (например, атеросклероз).


6.Иммуноглобулины:классификация,общая структура,место биосинтеза,функции,диагностическое значение.Понятие о белках системы комплемента.
Иммунные белки – иммуноглобулины (Ig). Содержание иммуноглобулинов резко увеличивается при иммунизации, хронических заболеваниях. Иммуноглобулины синтезируются в лимфоидной ткани селезенки, лимфоузлов, костного мозга и т.д. против чужеродных белков (антигенов). Их молекулярная масса составляет до Ix106 Да и более. Состоят из двух тяжелых полипептидных цепей (H-Heavy, Мм 50-75 кДа) и двух легких цепей L (Light, Мм 23 кДа), соединенных дисульфидными мостиками, (рис. 14.1.). Н-цепи имеют ≈ 700, а L-цепи ≈ 200 аминокислотных остатков. В пептидных цепях различают вариабельные (v) и постоянные константные (с) области. В результате различных сочетаний отдельных участков иммуноглобулинов может образовываться большое число индивидуальных иммуноглобулинов - до 107 .
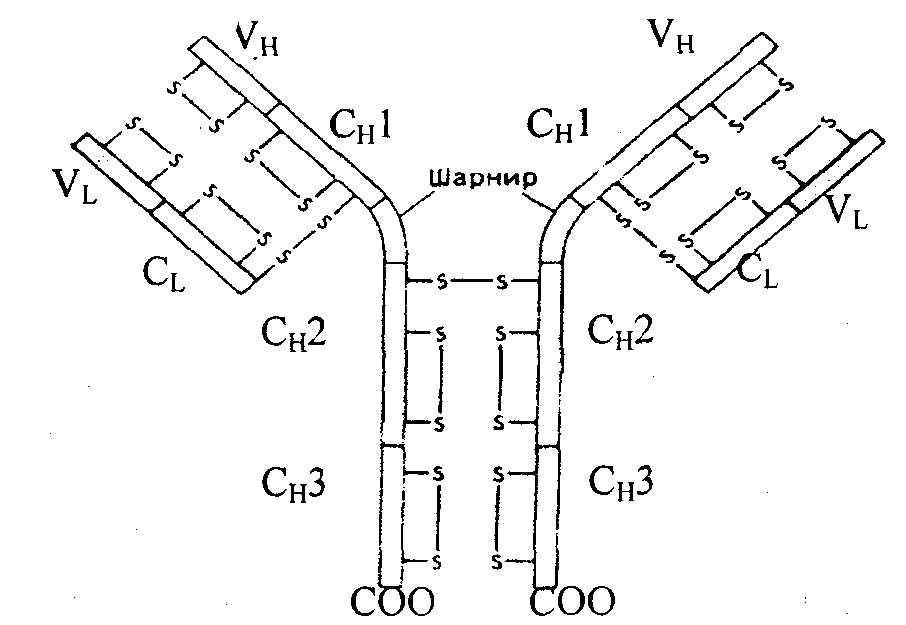
Рис. 14.1. Структура молекулы иммуноглобулина.
Две легкие и две тяжелые цепи удерживаются вместе дисульфидными связями. Каждая из легких и тяжелых цепей имеет на своем N- конце вариабельный yчасток (VL или VH). B состав легких цепей входит один константный участок (CL); у тяжелых цепей константная часть состоит из четырех доменов (СН1, СН2, СнЗ и шарнирный участок).
Иммуноглобулины синтезируются В-лимфоцитамиили образующимися из них плазматическими клетками. Известно 5 классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE, при этом IgG, IgA и IgM – основные классы; IgD и IgE – минорные классы иммуноглобулинов плазмы человека. Молекула иммуноглобулина состоит из двух идентичных пар полипептидных цепей. Каждая пара в свою очередь состоит из двух разных цепей: легкой (L) и тяжелой (Н).

