
- •1.Кровь:определение понятие,клеточный состав,его содержание в %.Плазма и сыворотка крови:понятие,методы получения,функции крови.
- •4.Альбумины сыворотки крови:место биосинтеза,особенности состав,структуры,физико-химических свойств,функций.
- •5.Белки острой фазы воспаления:d1-антитрипсин,2d-макроглобулин,гаптоглобулин,с-реактивный белок-механизмы повышения их уровня в крови при воспалении,диагностическое значение.
- •6.Иммуноглобулины:классификация,общая структура,место биосинтеза,функции,диагностическое значение.Понятие о белках системы комплемента.
- •7.Остаточный азот:понятие,состав,физиологическая роль и клиннико-диагностическое значение.
- •9.Ферменты плазмы крови:классификация,использование в энзимдиагностике.
- •Биохимия форменных элементов крови.
- •2.Особенности метаболизма веществ в эритроците:обмен метгемоглобина,связь с гликолизом.
- •3.Механизмы свободно-радикального окисления(сро) и антиоксидантная защита в эритроцитах(аоз).Самый еб*утый вопрос,надеюсь он никому не попадется)
- •4.Гемоглобин строение,функции,типы.Талассемии.Миоглобин:строение,функции,отличие от гемоглобина.
- •5.Биосинтез гема в организме человека:локализация,субстраты,ферменты,этапы и регуляция.Порфирин.
- •6.Связывание гемоглобина с кислородом(тритерный механизм),кооператорный аллостерический эффект.Кривая насыщения гемоглобина и миоглобина кислородом.
- •7.Сродство гемоглобина к кислороду и его регуляции(эффект Бора,влияние 2,3-дифосфоглицерата).
- •8.Транспорт углекислого газа эритроцитом.
- •9.Лейкоцит:функции,химический состав,особенности обмена веществ.Биохимические аспекты фагоцитоза.
- •Свертывающие и противосвертывающие системы крови.Фибринолиз
- •2.Функции сосудистого эндотелия,субэндотелия и тромбоцитов.
- •3.Первичный сосудисто-тромбоцитарный гемостаз.Участие тромбоксана и простоциклина в регуляции первичного гемостаза.
- •4.Понятие о синдроме диссеминированного внутрисосудистого свертывания(двс-синдром):причины,стадии,биохимические аспекты лечения.
- •5.Вторичный плазменный (коагуляционный) гоместаз:внутрений и внешней механизм свертывания.Взаимодействия внешнего и внутренного механизма свертывания.
- •7.Наследственные гемофилии:причины,принципы лечения.
- •8.Такой же как и 4,хз почему 2 раза,ах да это же 7 этаж,пережить и сдать,забыть как страшный сон,но память все равно останется)
- •1.Системный гомеостаз железа в организме человека этапы обмена,основные клетки,принимающие участие в обмене железа,суточные нормы и источники железа.
- •1. Регуляция всасывания в кишечнике.
- •2. Поддержание рециркуляции железа эритроцитов.
- •3. Регуляция количества поступающего в клетку железа.
- •2.Виды железа,поступающего с пищей и особенности его всасывания в тонком кишечнике.
- •3.Метаболизм железа в энтерецитах,характеристика основных белков и ферментных систем,судьба всосавшегося железа в энтерцитах в зависимости от концентрации железа в крови.
- •6.Контроль поступления железа в кровь из кишечника и макрофагов:роль гепсидина,факторы,влияющие на его синтез.
- •7.Регуляция обмена железа в организме человека:система ire/irPи ее роль в синтезе апоферритина и рецепторов трансферина на уровне трансляции этих белков.
- •3. Ферритин и гемосидерин внутренних органов;
- •9.Нарушение обмена железа:биохимические основы развития жледезофицитной анемии и гемохроматоза.
2.Виды железа,поступающего с пищей и особенности его всасывания в тонком кишечнике.
Всасывание
При попадании в желудок под действием HCl желудочного сока железо высвобождается из элементов пищи.
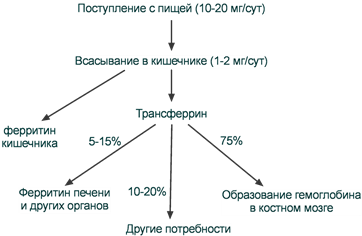
Всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1,0-2,0 мг/день (10-15% пищевого железа). При этом железо должно быть в виде двухвалентного иона, в то же время с пищей поступает преимущественно трехвалентное железо. Для восстановления Fe3+ в Fe2+ используется аскорбиновая кислота и соляная кислота. Только железо мясных продуктов находится в двухвалентной гемовой форме, и поэтому хорошо всасывается.
Три пути всасывания железа в кишечнике

Регуляция всасывания
Транскрипционные факторы, от активности которых зависит экспрессия DMT и HCP1, чувствительны к содержанию железа в энтероците и к степени внутриклеточной гипоксии. Больные с выраженной железодефицитной анемией способны повышать абсорбцию железа до 20-40 мг/сут.
Останется железо в энтероците или будет выводиться в кровь зависит от насыщенности им трансферрина. При "пустом" трансферрине железо будет более активно переноситься через базолатеральные мембраны наружу и присоединяться к трансферрину.
Значительно лучше железо всасывается из мясных продуктов – на 20-30%, из яиц и рыбы – на 10-15%, меньше всего железо всасывается из растительных продуктов – на 1-5%.
Наличие в пище фитиновой кислоты (сухие завтраки, растительные продукты), кофеина и танина (чай, кофе, напитки), фосфатов, оксалатов (растительные продукты) ухудшает всасывание железа, т.к. они образуют нерастворимые комплексы.
3.Метаболизм железа в энтерецитах,характеристика основных белков и ферментных систем,судьба всосавшегося железа в энтерцитах в зависимости от концентрации железа в крови.
Обнаружены три способа перемещения железа из просвета кишечника в энтероциты:
1. Негемовое железо (III) захватывается интегрином, восстанавливается до Fe (II) параферритином, и при помощи мобилферрина перемещается к месту использования, роль этого пути невысока.
2. Негемовое железо (III) восстанавливается до Fe (II) при помощи аскорбиновой кислоты, соляной кислоты или при участии ферроредуктазы (DcytB, дуоденального цитохрома B) и далее переносится внутрь белком DMT-1 (divalent metal ion transporter-1).
3. Гемовое железо связывается с белком НСР1 (heme carrier protein 1), и в цитозоле высвобождается из гема при действии гемоксигеназы, и далее переносится по клетке.
После всасывания формируется пул внутриклеточного железа. Далее железо может
-
остаться в клетке в составе ферритина (Fe3+),
-
выходить из клетки при помощи ферропортина, окисляться гефестином (феррооксидазой) и связываться с трансферрином (Fe3+).

4.Особенности транспорта железа в крови и поступления его в клетки:трансферин его строение,роль,характеристика рецепторов трансферрина,цикл трансферина.


Система IRE/IRP
Регуляцию поступления железа в клетку обеспечивает система IRE/IRP (англ. IRE, iron-responsive element - железочувствительный элемент и IRP, iron-responsive element-binding proteins - белок, связывающийся с железочувствительным элементом). Основой регуляции является наличие особого участка на матричной РНК - железочувствительного элемента IRE, связывающего специфичный к нему белок IRP.
В данном случае используется способность молекул IRP связываться с участком IRE соответствующих мРНК для двух белков – рецептора трансферрина и ферритина. При этом в комплексе с железом IRP не активен и не присоединяется к мРНК, без железа - может присоединяться.
1. Присоединение IRP к мРНК рецептора трансферрина ближе к ее 3'-концу защищает мРНК от разрушения РНКазами, действующими с 3'-конца мРНК:
-
при низкой концентрации железа в клетке белок IRP является активным, присоединяется к мРНК и, как следствие, мРНК рецепторов трансферрина существует дольше, образуется больше белков-рецепторов и повышается поток железа в клетки.
-
при высоком содержании железа в клетке белок IRP присоединяет железо, становится неактивным, с мРНК связаться не может и, соответственно, не защищает ее от разрушения. Синтез рецепторов к трансферрину не происходит, дополнительное железо клеткой не захватывается.

Метаболизм железа
После всасывания железо либо откладывается в клетках кишечника в составе ферритина, либо сразу попадает в кровоток и в комплексе с трансферрином переносится в клетки печени, костного мозга или других тканей. Нагруженный железом трансферрин (холотрансферрин) взаимодействует со своим специфическим мембранным рецептором. Трансферриновый рецептор на низком уровне экспрессируется во всех типах клеток, на высоком уровне – в активно делящихся клетках.
Наибольшее количество трансферриновых рецепторов находится на поверхности эритробластов (300 тыс - 400 тыс на одну клетку). Период полужизни комплекса трансферрин-Fe не превышает 60-90 мин и большая часть железа, транспортируемая трансферрином, поступает в костный мозг. При усиленном эритропоэзе период полужизни комплекса сокращается до 10-15 мин, в противоположной ситуации он удлиняется до нескольких часов.
Пути поступления и использования ионов железа
Роль рецептора к трансферрину
После образования тройного комплекса (железо, апотрансферрин, рецептор) он перемещается в цитоплазму эндоцитозом и оказывается внутри эндосом. На мембране эндосомы присутствует H+-АТФаза, создающая кислый рН внутри эндосом. В результате железо диссоциирует из комплекса и составляет свободный пул.

Трансферриновый рецептор и перенос железа внутрь клетки.
5.Особенности депонирования железа в клетках и ответ на прошлый.
В плазме крови железо транспортирует белок трансферрин. Трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. Одна молекула трансферрина может связать один или два иона Fe3+, но одновременно с анионом СО32- с образованием комплекса трансферрин-2 (Fe3+-CO32-). В норме трансферрин крови насыщен железом приблизительно на 33%.
Трансферрин взаимодействует со специфическими мембранными рецепторами клеток. В результате этого взаимодействия в цитозоле клетки образуется комплекс Са2+-кальмодулин-ПКС, который фосфорилирует рецептор трансферрина и вызывает образование эндосомы. АТФ-зависимый протонный насос, находящийся в мембране эндосомы, создаёт кислую среду внутри эндосомы. В кислой среде эндосомы железо освобождается из трансферрина. После этого комплекс рецептор - апотрансферрин возвращается на поверхность плазматической мембраны клетки. При нейтральном значении рН внеклеточной жидкости апотрансферрин изменяет свою конформацию, отделяется от рецептора, выходит в плазму крови и становится способным вновь связывать ионы железа и включаться в новый цикл его транспорта в клетку. Железо в клетке используется для синтеза железосодержащих белков или депонируется в белке ферритине.
Депонирование железа Ферритин – белок апоферритин + гидрат закиси Fe +3 (FeOOH) В среднем 1 молекула ферритина содержит около 2000 атомов Fe +3 Ферритин локализуется преимущественно внутриклеточно Ферритин, циркулирующий в крови, практически не участвует в депонировании железа, однако его уровень коррелирует с уровнем депонированного железа Гемосидерин - кристаллизация ферритина в сидеросомах + другие компоненты В макрофаге в аморфном состоянии Не растворим в воде железо с трудом мобилизуется и практически не используется .

