
- •1. Сериальные закономерности атомных спектров.
- •19. Влияние межмолекулярных взаимодействий на спектр молекулы.
- •2. Тонкое расщепление атомных спектров. Спин-орбитальное взаимодействие.
- •17. Классификация электронных переходов в молекулах, соотношения между интенсивностями спектральных линий различных типов переходов.
- •3. Систематика спектров многоэлектронных атомов.
- •10. Колебательно-вращательные спектры двухатомных молекул.
- •5. Особенности спектральных термов в приближении “j-j” связи.
- •6. Общая характеристика спектров молекул.
- •7. Вращательные спектры двухатомных молекул в приближении жёсткого ротатора.
- •11. Колебательно-вращательные спектры многоатомных молекул.
- •12. Связь между характером колебаний и интенсивностью колебательных полос поглощения.
- •13. Классификация нормальных колебаний по форме и симметрии молекул.
- •16. Вероятность электронно-колебательных переходов.
- •8. Вращательные спектры многоатомных молекул.
- •18. Методы описания межмолекулярных взаимодействий.
- •20. Изменения спектров поглощения и люминесценции растворов по сравнению со спектрами газов. Принцип Франка-Кондона для межмолекулярных взаимодействий.
- •4. Особенности спектральных термов в приближении “l-s” связи.
- •9. Колебательные спектры двухатомных молекул
- •14. Спектры комбинационного рассеяния молекул
- •15. Электронные состояния двухатомных молекул.
2. Тонкое расщепление атомных спектров. Спин-орбитальное взаимодействие.
У
атома водорода есть спиновое квантовое
число s, соответствующее моменту
количества движения
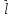 .
Наличие у электрона спина обуславливает
наличие спинового магнитного момента.
.
Наличие у электрона спина обуславливает
наличие спинового магнитного момента.
Возникает спин-орбитальное взаимодействие, энергия которого
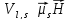 ,
,
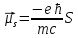 ,
,
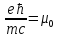 ,
по модулю:
,
по модулю:
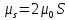 ,
,
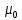 – магнетон Бора.
– магнетон Бора.
Напряженность
магнитного поля:
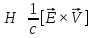 ,
напряженность электрического поля:
,
напряженность электрического поля:
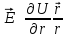 ,
U
– потенциальная энергия кулоновского
взаимодействия.
,
U
– потенциальная энергия кулоновского
взаимодействия.
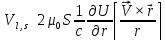
Момент импульса электрона, движущегося вокруг ядра:
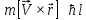 ,
,
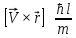
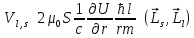 .
.
Так как спин-орбитальное взаимодействие зависит от скалярного произведения орбитального и спинового моментов, а следовательно от их взаимного расположения, то величина этого взаимодействия должна определяться полным моментом количества движения, являющегося векторной суммой орбитального и спинового моментов:
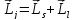 ,
,
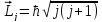 ,
где j – квантовое число полного
механического момента:
,
где j – квантовое число полного
механического момента:
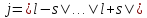 ,
если
,
если
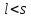 :
:
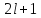 и если
и если
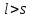 :
:
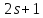
Для водорода j = l±1/2, поэтому за счет спин-орбитального взаимодействия уровни с l≠0 расщепляются на две компоненты.
Проекция
полного момента на выбранное направление
определяется квантовым числом
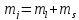 .
При заданных j:
.
При заданных j:
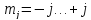 ,
всего 2j+1 значение. Следовательно,
каждому уровню с квантовыми числами
(m, l, j) будет соответствовать 2j+1 состояние,
отличающееся значениями
,
всего 2j+1 значение. Следовательно,
каждому уровню с квантовыми числами
(m, l, j) будет соответствовать 2j+1 состояние,
отличающееся значениями
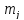 .
(28)
.
(28)
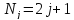 – статистический
вес уровня.
Значение j указывается справа внизу
около обозначения состояния электрона.
– статистический
вес уровня.
Значение j указывается справа внизу
около обозначения состояния электрона.
Полный момент количества движения всякой изолированной системы должен сохраняться, поэтому значением j можно характеризовать состояние изолированного атома.
Расщепление, возникающее за счет спин-орбитального взаимодействия, называется тонким или мультиплетным расщеплением.
Совокупность
спектральных линий, образованных
переходами между компонентами тонкой
структуры уровней, называют мультиплетами.
При их возникновении должно выполняться
следующее правило отбора:
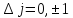 .
.
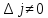 при
при
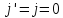 .
.
Для
атома водорода и водородоподобных
ионов величина энергии тонкого
расщепления пропорциональна 4-ой степени
зарядового числа:
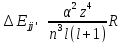 ,
где
,
где
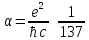 – постоянная тонкого расщепления.
– постоянная тонкого расщепления.
-----------------------------------------------------------
17. Классификация электронных переходов в молекулах, соотношения между интенсивностями спектральных линий различных типов переходов.
Одной из самых удачных и распространенных является классификация, учитывающая характер изменения электронного строения молекулы при поглощении или излучении кванта света. В основе ее лежит представление о состоянии оптического электрона до и после квантового перехода.
По этой классификации в особую группу выделяют переходы, обусловленные оптическим возбуждением электронов, локализованных около различных атомов. Такое возбуждение сопровождается изменением главного квантового числа атомных орбиталей и не приводит к переходу электронов на молекулярные орбитали. Данные переходы приводят к спектру, напоминающему чисто атомные спектры. Спектральные линии располагаются в области вакуумного УФ и характеризуются высокой интенсивностью. Такие переходы называются Ридберговыми.
В
тех случаях, когда в молекуле имеются
атомы O, N, S или Cl с неподеленными
электронами, при оптическом возбуждении
может происходить переход этих атомных
электронов на молекулярные орбитали.
Спектральные линии, возникающие в
результате этих переходов, лежат в УФ
(100-300 нм). Для них характерна невысокая
интенсивность (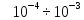 от интенсивности линей 1-ой группы)
от интенсивности линей 1-ой группы)
К 3-ей группе относят переходы, связанные с возбуждением чисто молекулярных электронов, участвующих в образовании химической связи. Спектральные линии лежат в ближнем УФ и видимой области. Интенсивность сравнима с интенсивностью 1-ой группы.
В
особую группу выделяют переходы с
внутримолекулярным переносом заряда
(ВПЗ переходы). Эти переходы сопровождаются
происходящим при оптическом возбуждении
перераспределении электронной плотности
между двумя или более обособленными
электронными системами в пределах
одной и той же молекулы.
(78)
Т.е. в этом случае происходит переход
электронов с орбиталей одной локальной
системы, выступающей в роли донора, на
орбитали другой локальной системы,
выступающей в роли акцептора. Типичным
примером молекулы, длинноволновая
полоса которой является ВПЗ полосой,
служит молекула нитробензола, у которой
донорная часть – CH группы, а акцепторная
-
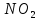 группа. Частоты переходов с ВПЗ во
многих случаях можно оценить, зная
энергетические характеристики
взаимодействия группировок
группа. Частоты переходов с ВПЗ во
многих случаях можно оценить, зная
энергетические характеристики
взаимодействия группировок
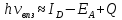
Здесь
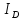 – потенциал ионизации донорной группы;
– потенциал ионизации донорной группы;
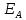 – энергия сродства электрона акцепторной
группы; Q
– постоянная полосы.
– энергия сродства электрона акцепторной
группы; Q
– постоянная полосы.
Полосы ВПЗ наиболее интенсивны среди всех известных электронных полос. Их интенсивность примерно в 3-5 раз больше интенсивности полос 1-ой группы.
