
- •1. Броуновское движение
- •2. Законы идеального газа
- •3. Барометрическая формула.
- •4. Основное уравнение молекулярно-кинетической
- •5. Распределение Максвелла
- •6. Средняя длина свободного пробега
- •Vмол30 1030 м3, м.
- •7. Явления переноса
- •Диффузия в газах
- •8. Внутреннее трение
- •Теплопроводность
- •9. Первое начало термодинамики
- •10. Классическая теория теплоемкости
- •11. Адиабатический процесс
- •12. Политропический процесс
- •13. Энтропия. Второе и третье начала термодинамики
- •14. Расчет изменения энтропии в процессах
- •15. Цикл Карно. Второе начало термодинамики
- •16. Реальные газы. Критическое состояние
- •17. Уравнение Ван-дер-Ваальса
- •18. Особенности жидкого состояния вещества
- •19. Свободная энергия как функция состояния
- •Поверхностное натяжение
- •20. Условия равновесия на границах различных сред
- •21. Формула Лапласа
- •22. Фаза. Фазовое равновесие. Общая характеристика фазовых переходов 1-го и 2-го рода
- •23. Уравнение Клапейрона Клаузиуса.
- •24. Эффект Джоуля-Томсона
- •25. Методы получения низких температур
- •26. Термодинамическая шкала температур.
- •27. Симметрия кристаллов. Дефекты в кристаллах
- •Классическая теория теплоемкости твердых тел
- •28. Понятие о квантовой статистике. Распределения
- •29. Понятие о квантовой теории теплоемкости.
- •Рекомендуемая литература*
5. Распределение Максвелла
Пусть имеется N молекул, находящихся в тепловом движении. Их скорости хаотически меняют величину и направление. Максвелл в 1860 г. показал, что, несмотря на хаотичность, существует строго определенное и однозначное распределение скоростей между молекулами.
О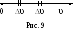 тложим
на оси скорости все возможные скорости
молекул (рис. 9). Найдем количество молекул
N,
скорости которых заключены в интервале
[υ,
υ
+ υ].
Очевидно, это количество N
будет пропорционально общему числу
молекул N,
величине интервала скорости υ
и функции
распределения молекул по скоростям
F(υ):
тложим
на оси скорости все возможные скорости
молекул (рис. 9). Найдем количество молекул
N,
скорости которых заключены в интервале
[υ,
υ
+ υ].
Очевидно, это количество N
будет пропорционально общему числу
молекул N,
величине интервала скорости υ
и функции
распределения молекул по скоростям
F(υ):
![]() ,
или
,
или
![]() ,
или
,
или
![]() .
.
Физический
смысл
F(υ):
при υ
= 1
функция
![]()
доля частиц от общего числа, скорости
которых заключены в единичном интервале
вблизи скорости υ.
доля частиц от общего числа, скорости
которых заключены в единичном интервале
вблизи скорости υ.
Условие
нормировки:
![]() ,
т.е. число частиц, имеющих скорости в
интервале [0, ],
равно N
(а
N/N
= 1).
,
т.е. число частиц, имеющих скорости в
интервале [0, ],
равно N
(а
N/N
= 1).
О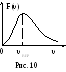 дна
из форм записи функции распределения
Максвелла имеет вид:
дна
из форм записи функции распределения
Максвелла имеет вид:
![]() ,
(19)
,
(19)
где υ – скорость на длине свободного пробега;
m – масса одной молекулы;
k – постоянная Больцмана;
Т – температура.
График функции F(υ) показан на рис. 10.
Как и следовало ожидать F(υ) = 0 при υ = 0 и υ = , т.е. в газе нет неподвижных молекул и движущихся с бесконечно большими скоростями.
Найдем наиболее вероятную скорость υВЕР, определяющую максимум кривой распределения. Для этого следует взять производную и приравнять ее к нулю (постоянные множители при этом вынесутся за знак производной):
 ,
,
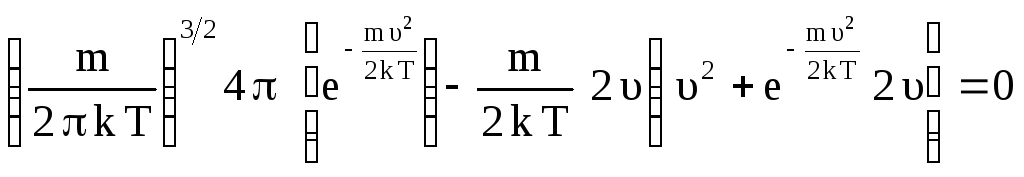 ,
,
![]() .
.
Корнями последнего уравнения будут:
![]() ,
,
![]() ,
,
![]() .
.
Первые два корня – это минимумы функции F(υ), а третий корень – это максимум (наиболее вероятная скорость):
![]() .
(20)
.
(20)
Найдем значение функции распределения в максимуме, подставив формулу (20) в уравнение (19):
![]() ,
,
![]() .
(21)
.
(21)
И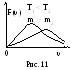 з
формул (20) и (21) следует, что при увеличении
температуры или уменьшении массы
молекулы максимум кривой смещается
вправо и становится ниже (рис. 11). Однако,
площадь под кривой из условия нормировки
(S
= 1)
сохраняется.
з
формул (20) и (21) следует, что при увеличении
температуры или уменьшении массы
молекулы максимум кривой смещается
вправо и становится ниже (рис. 11). Однако,
площадь под кривой из условия нормировки
(S
= 1)
сохраняется.
Зная функцию распределения F(υ), можно найти среднюю (арифметическую) скорость:
![]() .
(22)
.
(22)
Так, например, для температуры 300 К средние скорости молекул кислорода и водорода равны соответственно 445 м/с и 1782 м/с.
Функции
F(υ)
можно придать другой вид, удобный при
расчетах, если ввести относительную
скорость:
![]() .
.
Тогда
![]() ,
,
![]() .
.
Если
подставить получившиеся выражения для
υ
и dυ
в формулу
![]() ,
то можно получить функцию распределения
F(u)
для относительной скорости:
,
то можно получить функцию распределения
F(u)
для относительной скорости:
![]() ,
,
![]() ,
где
,
где
![]() .
(23)
.
(23)
У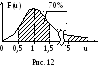 70% всех молекул скорость отличается от
наиболее вероятной не более чем на 50%
(рис. 12). А скорости, превышающие наиболее
вероятную более чем в 5 раз, наблюдаются
у одной из 12 млрд молекул.
70% всех молекул скорость отличается от
наиболее вероятной не более чем на 50%
(рис. 12). А скорости, превышающие наиболее
вероятную более чем в 5 раз, наблюдаются
у одной из 12 млрд молекул.
Распределение Максвелла позволяет объяснить существование и рассеяние атмосферы планет. Чтобы покинуть Землю, молекула должна иметь скорость, превышающую вторую космическую (11,2 км/с). Эта скорость в 25 раз превышает наиболее вероятную скорость для молекул кислорода. Поэтому число покинувших Землю молекул кислорода очень мало. Однако легкие газы (водород, гелий) в основном рассеялись и остались "тяжелые" газы с небольшой скоростью молекул (азот, кислород, аргон, углекислый газ).
Атмосферы сохранились у тех планет, у которых сильное тяготение (высокая вторая космическая скорость) и низкая температура (низкая скорость самих молекул). Атмосферы состоят в основном из "тяжелых" газов – азот, кислород, аммиак, метан и т.п.
