
- •Материальная точка и её поступательное движение.
- •Закон инерции (I закон Ньютона).
- •Инерциальные системы отсчёта.
- •Скорость и ускорение.
- •Кратные и дольные приставки.
- •Вращательное движение материальной точки. Основные параметры.
- •Угловой путь и угловое ускорение.
- •Угловая скорость. Связь с моментом силы.
- •Второй закон Ньютона и его выражение через импульс.
- •Сила и её свойства. Единица силы.
- •Масса и её свойства. Единица массы. Эталон.
- •Закон изменения импульса.
- •Центр масс и закон его движения.
- •II закон Ньютона для вращательного движения.
- •Момент силы и его направление.
- •Закон сохранения импульса. Вывод.
- •Закон сохранения механической энергии.
- •Закон сохранения момента импульса.
- •Космические скорости. Вывод формулы для расчёта первой космической скорости.
- •Кинетическая и потенциальная энергии.
- •О физическом смысле понятия потенциальной энергии
- •Силы инерции.
- •Механический принцип относительности Галилея.
- •Постулаты специальной теории относительности (сто).
- •Следствия сто для массы, длины и времени при скорости тела, стремящейся к световой.
- •Закон взаимосвязи массы и энергии.
- •Электростатическое поле и его основные характеристики.
- •Основные характеристики:
- •Силовые линии электростатического поля
- •Закон Кулона.
- •Электростатическое поле в диэлектрической среде.
- •Теорема Остроградского-Гаусса и её применение. Вывод.
- •Дипольный момент молекулы как вектор.
- •40. Закон Ома в деференциальной форме
- •41. Закон Фарадея для электролиза
- •42. Химический и электро-химический эквивалент
- •43. Число Фарадея
- •44. Действие магнитного поля на движущийся заряд
- •45. Действие магнитного поля на движущийся проводник с током
- •46. Основной закон электромагнитной интерации Фарадея
- •47. Явление самоиндукции
- •48. Свойство индуктивности и физический смысл понятия индуктивности и её единица
- •49. Свободные гармонические колебания и их основные параметры
- •50.Уравнение гармонических колебаний
- •51. Колебания пружинистых и математических
-
Теорема Остроградского-Гаусса и её применение. Вывод.
-
Дипольный момент молекулы как вектор.
Дипольный
момент молекулы -
характеризует электрич. свойства
молекулы. Д. м. м. 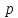 равен:
равен: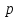
![]() ,
где
,
где ![]() -заряды составляющих
молекулу частиц,
-заряды составляющих
молекулу частиц, ![]() -
их радиусы-векторы относительно
произвольно выбранного начала координат.В
этом случае заряды считают точечными,
однако электронный заряд в молекулах
распределён непрерывно, поэтому, строго
говоря, суммирование нужно заменить
интегрированием. Д. м. м. можно представить
иначе: суммарный положит. заряд (+Q)
электронейтральной молекулы и её
суммарный отрицат. заряд (-Q)
можно стянуть в нек-рые точки (их положение
определяется аналогично нахождению
положения центра масс твёрдого тела);
если расстояние между +Q и - Q равно от +Q
до -Q,
то
-
их радиусы-векторы относительно
произвольно выбранного начала координат.В
этом случае заряды считают точечными,
однако электронный заряд в молекулах
распределён непрерывно, поэтому, строго
говоря, суммирование нужно заменить
интегрированием. Д. м. м. можно представить
иначе: суммарный положит. заряд (+Q)
электронейтральной молекулы и её
суммарный отрицат. заряд (-Q)
можно стянуть в нек-рые точки (их положение
определяется аналогично нахождению
положения центра масс твёрдого тела);
если расстояние между +Q и - Q равно от +Q
до -Q,
то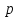
![]() .
Д. м. м. измеряется в дебаях и
обычно имеет порядок 1 Д.
.
Д. м. м. измеряется в дебаях и
обычно имеет порядок 1 Д.
Вектор дипольного момента направлен от центра тяжести отрицат. зарядов к центру тяжести положительных.
------
40. Закон Ома в деференциальной форме
Сопротивление ![]() зависит
как от материала, по которому течёт ток,
так и от геометрических размеров
проводника.
зависит
как от материала, по которому течёт ток,
так и от геометрических размеров
проводника.
Полезно переписать закон Ома в так называемой дифференциальной форме, в которой зависимость от геометрических размеров исчезает, и тогда закон Ома описывает исключительно электропроводящие свойства материала. Для изотропных материалов имеем:
![]()
где:
-
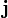 —
вектор плотности
тока,
—
вектор плотности
тока, -
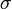 — удельная
проводимость,
— удельная
проводимость, -
 —
вектор напряжённости
электрического поля.
—
вектор напряжённости
электрического поля.
41. Закон Фарадея для электролиза
В современной интерпретации законы электролиза гласят, что (1) количество продуктов химических реакций в процессе электролиза пропорционально силе заряда и (2) количество продуктов химических реакций, которым подвергается вещество в результате воздействия некоторого количества электрического тока, пропорционально электрохимическому эквиваленту вещества.
42. Химический и электро-химический эквивалент
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Электрохимический эквивалент или электролитический эквивалент — закон Фарадея, устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества. Согласно этому закону, при прохождении одного и того же гальванического тока через ряд вольтметров, количества веществ, выделившихся на электродах, должны быть в отношении их эквивалентных весов. Этим и пользуются для определения величины эквивалентов простых тел. Такие найденные электролизом величины можно назвать электрохимическим или электролитическим
43. Число Фарадея
Фарадея число, Фарадея постоянная (F), одна из фундаментальных физических постоянных, равная произведению Авогадро числа NA на элементарный электрический заряд е (заряд электрона): F = NA (е = (9,648456 ± 0,000027) (104 к моль-1. Ф. ч. широко применяется в электрохимических расчётах. Названо в честь М. Фарадея, открывшего основные законы электролиза.
