
- •А.Н. Королев, г.А. Галимова
- •Таганрогский государственный радиотехнический университет
- •Содержание
- •Орбитальное квантовое число
- •Магнитное квантовое число
- •Атомные орбитали
- •Спиновое квантовое число
- •Многоэлектронные атомы. Правило Клечковского. Принцип Паули. Следствие из принципа Паули. Правило Хунда
- •Правило Клечковского
- •Принцип Паули (принцип запрета)
- •Правило Хунда
- •Лекция 2 Систематика химических элементов
- •1. Периодическая система химических элементов
- •2. Периодическое изменение свойств атомов химических элементов
- •Обменный механизм образования ковалентной связи. Свойства ковалентной связи. Валентность
- •Донорно-акцепторный механизм образования ковалентной связи
- •2. Направленность ковалентной связи. Гибридизация атомных орбиталей. Пространственная конфигурация молекул. Полярные и неполярные молекулы
- •Полярные и неполярные молекулы
- •Лекция 4 Взаимодействие между молекулами
- •1. Вандерваальсовы силы: ориентационная, индукционная и дисперсионная составляющие. Полная энергия межмолекулярного взаимодействия
- •2. Водородная связь
- •Лекция 5 Строение кристаллов. Химическая связь в твердых телах
- •1. Кристаллическая решетка. Координационное число
- •2. Энергия кристаллической решетки. Типы кристаллов: молекулярные, ковалентные, ионные и металлические
- •Молекулярные кристаллы
- •Ковалентные кристаллы
- •Ионная связь. Ионные кристаллы
- •Металлические кристаллы
- •2. Теплота. Работа. Первое начало термодинамики
- •2. Теплота образования. Теплота сгорания. Следствия из закона Гесса
- •2. Свободная энергия Гельмгольца. Свободная энергия Гиббса
- •Энергия активации химической реакции
- •2. Закон действующих масс. Правило Вант-Гоффа
- •Правило Вант-Гоффа
- •2. Принцип Ле Шателье
- •2. Гомогенный и гетерогенный катализ
- •Закон Генри
- •Закон Рауля
- •2. Кипение и замерзание растворов
- •Слабые электролиты. Константа диссоциации
- •2. Ионное произведение. Водородный показатель. Произведение растворимости Ионное произведение. Водородный показатель
- •Водородный показатель
- •Произведение растворимости
- •2. Гальванический элемент Даниэля-Якоби. Электродвижущая сила элемента Гальванический элемент Даниэля-Якоби
- •Электродвижущая сила элемента
- •2. Потенциал металлического электрода
- •Библиографический список
2. Потенциал металлического электрода
При погружении металла в раствор собственных ионов устанавливается следующее равновесие:
![]()
При равновесии растворение металла равно скорости разряда его ионов.
Потенциал, который устанавливается на электроде при равновесии, называется равновесным потенциалом. Для его измерения необходим гальванический элемент следующего вида:
H2, Рt | H+ | | Men+ | Me,
в котором токообразующая реакция будет реакцией следующего типа:
Men+ + n/2Н2→Me + nH+.
ЭДС этого элемента будет равна потенциалу электрода по водородной шкале:
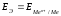 .
.
Поскольку [Н+]= 1, р(H2) = 1, то
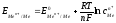 . (62)
. (62)
Уравнение (62) называется уравнением Нернста. Переходя от натурального логарифма к десятичному и подставляя во второе слагаемое температуру Т=298К и соответствующие значения R и F, получим расчетную форму уравнения Нернста:
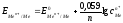 .
.
Для разбавленных растворов активность заменяется на концентрацию.
Стандартный электродный потенциал металла указывает на меру восстановительной способности его атомов и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он характеризуется. Чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы.
Библиографический список
-
Харин А.Н., Катаева Н.А., Харина Л.Т. Курс химии. М.: Высш. шк., 1983. 511с.
-
Глинка Н.Л. Общая химия. Л.: Химия, 1982. 720с.
-
Коровин Н.В., Масленникова Г.Н. и др. Курс общей химии. М.: Высш. шк., 1990. 445с.
-
Королев А.Н. Химия, Краткий конспект лекций. Таганрог. Изд-во ТРТУ, 2000. 90с.
