
- •6 Взаимодействие между молекулами. Комплексные соединения
- •6.1 Вандерваальсовы силы
- •6.2 Водородная связь
- •6.3 Комплексные соединения
- •6.3.1 Донорно-акцепторное взаимодействие молекул
- •6.3.2 Комплексы
- •6.3.3 Комплексообразователи
- •6.3.4 Лиганды
- •6.3..5 Номенклатура комплексных соединений
- •6.3.6 Роль комплексных соединений в природе и технике
- •6.3.7 Природа химической связи в комплексах. Структура и свойства комплексных соединений
- •6.4 Вопросы для самоконтроля
6.3 Комплексные соединения
6.3.1 Донорно-акцепторное взаимодействие молекул
Если одна из двух молекул имеет атом со свободными орбиталями, а другая - атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
N![]() +
B
+
B![]() =
N
=
N![]()
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора - вакантная орбиталь.
При взаимодействии по донорно-акцепторному механизму атом азота отдает на связь пару электронов, а атом бора- вакантную орбиталь, в результате чего возникает ковалентная связь
![]()
 .
.
В полученном соединении суммарные валентности бора и азота равны четырем.
6.3.2 Комплексы
Аналогичным образом образуется соединение КРF6 при взаимодействии КF и РF5 ,которое можно записать в виде К[РF6] . При взаимодействии сульфата меди и аммиака образуется сложное соединение
CuSO![]() + 4NH
+ 4NH![]() =CuSO
=CuSO![]() ∙ 4NH
∙ 4NH![]() ,
,
которое
выражается формулой [Cu(NH![]() )
)![]() ]
SO
]
SO![]() .
.
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений.
Согласно координационной теории швейцарского ученого А.Вернера комплексные соединения состоят из двух сфер: внешней и внутренней.
В приведенных выше
примерах внешними сферами являются К![]() и SO
и SO![]()
![]() .
Внутренняя сфера, называемая также
комплексом, включает центральный ион
или атом, вокруг которого координируются
отрицательно заряженные ионы или
нейтральные молекулы. При записи
комплексного соединения внутреннюю
сферу или комплекс заключают в скобки,
например[Zn(CN)
.
Внутренняя сфера, называемая также
комплексом, включает центральный ион
или атом, вокруг которого координируются
отрицательно заряженные ионы или
нейтральные молекулы. При записи
комплексного соединения внутреннюю
сферу или комплекс заключают в скобки,
например[Zn(CN)![]() ]
]![]() ,
[Zn(NH
,
[Zn(NH![]() )
)![]() ]
]
![]() .
.
Центральный ион
или атом называется комплексообразователем,
а координируемые им ионы или молекулы-
лиганидами. В приведенных выше примерах
комплексообразователями являются ион
фосфора в [PF![]() ]-
и ион меди Cu
]-
и ион меди Cu![]() в [Cu(NH
в [Cu(NH![]() )
)![]() ]
]![]() .Число
монодентантных лиганидов, координируемых
комплексообразовате- лем, называют
координационным числом. В приведенных
примерах координационное число равно
соответственно 6 и 4.
.Число
монодентантных лиганидов, координируемых
комплексообразовате- лем, называют
координационным числом. В приведенных
примерах координационное число равно
соответственно 6 и 4.
В зависимости от
заряда различают анионные комплексы,
например [PF![]() ]-,
, [Zn(CN)
]-,
, [Zn(CN)![]() ]
]![]() ,
[Al(OH)
,
[Al(OH)![]() ]-,
катионные комплексы, например [Cu(NH
]-,
катионные комплексы, например [Cu(NH![]() )
)![]() ]2+
,[Ni(H
]2+
,[Ni(H![]() O)
O)![]() ]
]![]() ,
и нейтральные комплексы, например [Ni(
CO
,
и нейтральные комплексы, например [Ni(
CO![]() )]
и [Pt(NH
)]
и [Pt(NH![]() )
)![]() Cl
Cl![]() ].
Нейтральные комплексы не имеют внешней
сферы. Заряд комплекса численно равен
алгебраической сумме заряда центрального
иона и зарядов лигандов.
].
Нейтральные комплексы не имеют внешней
сферы. Заряд комплекса численно равен
алгебраической сумме заряда центрального
иона и зарядов лигандов.
6.3.3 Комплексообразователи
Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d- элементов VII, VIII, I, II групп периодической таблицы элементов.
6.3.4 Лиганды
К числу лигандов
относятся простые анионы, такие как
F![]() ,Cl
,Cl![]() ,Br
,Br![]() ,I
,I![]() ,S2-,
сложные анионы, например CN
,S2-,
сложные анионы, например CN![]() ,
NCS
,
NCS![]() ,
NO
,
NO![]() ,
молекулы, например H
,
молекулы, например H![]() O,
NH
O,
NH![]() ,
CO,
H
,
CO,
H![]() NCH
NCH![]() CH
CH![]() NH
NH![]() (En).
Ионы или отдельные атомы ионов и молекул
лигандов имеют неподеленные пары
электронов. В зависимости от того , какое
число вакантных орбиталей у
комплексообразователя занимают лиганды,
они подразделяются на монодентантные(одна
орбиталь), например NH
(En).
Ионы или отдельные атомы ионов и молекул
лигандов имеют неподеленные пары
электронов. В зависимости от того , какое
число вакантных орбиталей у
комплексообразователя занимают лиганды,
они подразделяются на монодентантные(одна
орбиталь), например NH![]() ,
Cl
,
Cl![]() ,
бидентантные, например En,
полидентантные, например
этилендиаминтетрауксусная кислота
(ЕДТА), являющаяся шестидентантным
лигандов.
,
бидентантные, например En,
полидентантные, например
этилендиаминтетрауксусная кислота
(ЕДТА), являющаяся шестидентантным
лигандов.
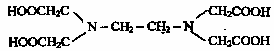 .
.
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комплексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
 .
.
