
- •§ 112. Магнитная постоянная. Единицы магнитной индукции и напряженности магнитного поля
- •§ 157. Стоячие волны
- •Лекция 18 Принцип Паули. Распределение электронов в атоме по состояниям. Периодическая система элементов Менделеева.
- •П3.2 Радиоактивное излучение и его виды
- •Лекция 19 п 3.3 реакция ядерного деления. Цепная реакция деления. Термоядерные реакции.
- •Лекция 20 Методы исследования. Опытные законы идеального газа.
- •Лекция 21 Основное управление молекулярно-кинетической теории идеальных газов.
Лекция 19 п 3.3 реакция ядерного деления. Цепная реакция деления. Термоядерные реакции.
Замечательной особенностью деления ядер является то, что оно сопровождается испусканием двух-трех вторичных нейтронов, называемых нейтронами деления. Большинство нейтронов при делении испускается практически мгновенно (t 10–14 с), а часть (около 0,7%) испускается осколками деления спустя некоторое время после деления (0,05 с t 60 с). Первые из них называются мгновенными, вторые — запаздывающими.
Вероятность
деления ядер определяется энергией
нейтронов. Например, если высокоэнергетичные
нейтроны (см. § 264) вызывают деление
практически всех ядер, то нейтроны с
энергией в несколько мегаэлектрон-вольт
— только тяжелых ядер (А>210).
Нейтроны, обладающие энергией
активации (минимальной энергией,
необходимой для осуществления реакции
деления ядра) порядка 1 МэВ, вызывают
деление ядер урана
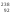 U,
тория
U,
тория
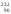 Th,
протактиния
Th,
протактиния
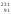 Ра
и плутония
Ра
и плутония
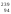 Pu.
Тепловыми нейтронами делятся ядра
Pu.
Тепловыми нейтронами делятся ядра
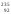 U,
U,
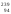 Pu
и
Pu
и
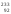 U,
U,
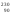 Th
(два последних изотопа в природе не
встречаются, они получаются искусственным
путем). Например, изотоп
Th
(два последних изотопа в природе не
встречаются, они получаются искусственным
путем). Например, изотоп
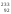 U
получается в результате радиационного
захвата (реакции (n,
), см. § 264)
нейтронов ядром
U
получается в результате радиационного
захвата (реакции (n,
), см. § 264)
нейтронов ядром
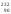 Th:
Th:
![]()
Испускаемые при делении ядер вторичные нейтроны могут вызвать новые акты деления, что делает возможным осуществление цепной реакции деления — ядерной реакции, в которой частицы, вызывающие реакциию, образуются как продукты этой реакции.
Во-первых, из-за конечных размеров активной зоны (пространство, где происходит цепная реакция) и большой проникающей способности нейтронов часть из них покинет активную зону раньше, чем будет захвачена каким-либо ядром.
Минимальные размеры активной зоны, при которых возможно осуществление цепной реакции, называются критическими размерами. Минимальная масса делящегося вещества, находящегося в системе критических размеров, необходимая для осуществления цепной реакция, называется критической массой.
Лекция 20 Методы исследования. Опытные законы идеального газа.
. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический.
Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамическая температурная шкала определяется по одной реперной точке, в качестве которой взята тройная точка воды (температура, при которой лед, вода и насыщенный пар при давления 609 Па находятся в термодинамическом равновесии). Удельный объем v — это объем единицы массы. Когда тело однородно, т. е. его плотность = const, то v=V/m=1/p. Закон Бойля—Мариотта*: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
![]() Закон
Авогадро*: моли любых газов при
одинаковых температуре и давлении
занимают одинаковые объемы. При нормальных
условиях этот объем равен 22,4110–3
м3/моль.
Закон
Авогадро*: моли любых газов при
одинаковых температуре и давлении
занимают одинаковые объемы. При нормальных
условиях этот объем равен 22,4110–3
м3/моль.
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:
![]()
![]()
Закон Дальтона*: давление смеси идеальных газов равно сумме парциальных давлений p1, p2 ,..., рn входящих в нее газов:
![]()
Парциальное давление — давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
* Дж. Дальтон (1766—1844) — английский химик и физик.
