
- •Химическая связь
- •Взаимное влияние атомов в органических молекулах
- •Пространственное строение органических молекул
- •Физико-химические методы идентификации
- •Общие закономерности реакционной способности органических соединений
- •Реакционная способность насыщенных углеводородов
- •Непредельные углеводороды
- •Ароматические углеводороды Арены
- •Галогенпроиводные углеводороды
- •Гидроксопроизводные углеводороды
- •Простые эфиры
- •Оксосоединения
- •Овр карбонильныхсоединений
- •Карбоновые кислоты
- •Функциональные производные карбновых кислот
- •Ароматические карбоновые кислоты
Галогенпроиводные углеводороды
Классификация:
В зависимости от числа и расположения атомов галогенов:
а) моноглогенпроизводные (1 галоген-заместитель)
CH3Cl – хлористый метил(хлорметан);
б) дигалогенпроизводные (2 галоген-заместителя)
CH2Cl2 – дихлорметан

в) тригалогенпроизводные (3 галоген-заместителя)
CHCl3 – хлороформ
Ит.д.
По строению углеродного скелета:
а) галогеналканы и галогенциклоалканы
б) галогеналкены
в) галогенарены
Способы получения:
- Действие галогенов на алканы и циклоалканы при обучении:
F реагирует энергичнее всех (со взрывом), Br - труднее всех.
I – производные таким способом не получить, т.к. образовавшийся HI является сильным восстановителем и восстанавливает образовавшееся йодопроизводное до алкана.
- Галогенирование алкенов;
- Гидрогалогенирование алкенов
К несимметричным алканам присоединяется в присутствии перикисных соединенй.
- Из спиртов:
а) R – OH + HCl→ H+ H2O + R – Cl
б) R – OH + PCl5→POCl3 + R – Cl + HCl
в) R – OH + PCl3→R – Cl + H3PO4
г) R – OH + SOCl2→R – Cl + SO2 + HCl
тионил хлорид
Химические свойства:
Наиболее храктерны реакции нуклеофильного замещения:
R→CH2δ+→Halδ-
Связь С-Hal поляризована. Реакция SN
в общем виде:

С учетом прочности и пояризуемости связи и стабильности уходящего галогена галогеналканы по реакционной способности располагаются в ряд:
Йодопроизводные>Бромопроизводные>Хлоропроизводные>Фторопроизводные
Бимолекулярное нуклеофильное замещение(SN2):
Гидролиз галгеналканов
Этот механизм характерен для первичных галогеналканов, а также для вторичных с небольшими по объему заместителями.
CH3I + NaOH→CH3OH + NaI
Водный р-р.
Механизм реакции:

Нуклеофил атакует положительно заряженный атом С со стороны противоположного отрицательного заряженного атома галогена.
Одновременно с образованием связи С – О связь С – Hal ослабляется.

Анион Hal выталкивается одновременно с образованием связи атома С с гидроксилом.
υобщ=R∙(OH-)∙CH3I
В результате атаки с тыльной стороны происходит обращение конфигурации. Если в реакцию вступает оптически активный алкилгалогенид R-ряда, то образуется S-изомер спирта.
Мономолекулярное нуклеофильное замещение(SN1):
Характерно для третичных алкилгалогенидов, в которых объем заместителя затрудняют проход Nu с тыльной стороны, а также вторичные с объемными заместителями.
(CH3)3CI+ NaOH→(CH3)COH + NaI
Водный р-р.
Механизм:

υобщ=R∙(СH3)3CI
Для оптически активных алкилгалогенидов после прохождения SN1 происходит рацеализация.
Другие реакции SN:
-
С
 пирты;
пирты; -
R – Cl + R’ONa→R –O – R’ + NaCl – простые эфиры.
Кислород -
содержащие эфиры
-
R
 – Cl + NaHS→R – SH + NaCl
– Cl + NaHS→R – SH + NaCl
т
Серосодержащие
эфиры
-
R – Cl + R' – SNa→R – S – R’ + NaCl
Сульфиды
-
R – Cl + R – S – R→

-
R – Cl + KCN→R – C≡N + KCl углеродсодержащие нуклеофилы
нитрилы
-
R – Cl + 2NH3→R – NH2 + NH4Cl
П
Азотсодержащие
нуклеофилы
R – NH2 + R – Cl→ +NH3 R – NH – R + NH4Cl
Вторичныйамин
R – Cl + R – NH – R → +NH3 R – N – R + NH4Cl
|
R Третичный амин
-
R – Cl + NaNO2→R – NO2 + NaCl
Нитросоединение
Для галогеналканов также характерны реакции элеминирования.
Бимолекулярное элиминирование E2:
Характерна для первичных алкилгалогенидов.

υ=K∙(B-)∙(C2H5Cl)
В общем случае элеминирование идет по правилу Зайцева, и отщепление идет от менее гидрированного атома С с образованием более замещенного алкена.

Мономолекулярное элеминирование:
Характерно для третичных.

υ=R∙(СH3)3CСl
Реакции SN и E являются конкурирующими, т.к.:
-
В первичных алкилгалогенидах преобладают реакции замещения, а в третичных – элеминирования.
-
Сильные основания (-NH2) способствуют элеминированию. E2>E1
-
G
Ди-, три- и полигалогенпроизводные:
С повышением числа галогенов у одного атома С связь С – Hal укорачивается. Поэтому они менее ракционноспособны, чем алкилгалогениды.
Получение дигалогенпроизводных:
а)

б) Из олефинов – вицинальные: алкен + Cl2
Получение тригалогенпроизводных:
Галоформионная реакция

Галогеналкены:
Если Hal и кратная связь удалены друг от друга, то они реагируют независимо друг от друга.
Винилхлорид: CH2=CHCl;
Получение: HC≡CH + 1HCl→CH2=CHCl;
Hal менее подвижен, т.к. Cl (его электроны) наодится в сопряжении с π-связью, в результате связь C – Cl укорачивается.

 ..
..
CH2=CH – Cl p,π – сопряжение
- Cl:, - I, +M.
Аллилхлорид: CH2=CH – CH2 – Cl;
Получение: CH2=CH – CH3 + Cl2 → SR, 500° CH2=CH – CH2Cl + HCl
В этом соединении повышена способность
к диссоциации, т.к. образовавшийся
карбокатион стабилизируется путем
стягивания π-электрона на положительно
заряженном атоме Н.
этом соединении повышена способность
к диссоциации, т.к. образовавшийся
карбокатион стабилизируется путем
стягивания π-электрона на положительно
заряженном атоме Н.
..
CH2=CH→CH2→Cl↔CH2=CH – CH2+
-Cl:, -I.
Галогенарены:
Галогенбензольное ядро провод. Hal в присутствии кислот Льюиса.

Если проводить бромирование при облучении, то идет замещение в боковой цепи.

Замещению в общем случае подвергается α-углеродный атом.

Hal прочно связан с ядром из-за π,р – сопряжения(малоподвижен, малореакционоспособен)
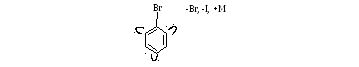
Нуклеофильное замещение происходит в жестких условиях.
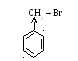
В бромистом бензиле Hal подвижен, т.к. нет сопряжения и легко замещается по механизму SN1.
Галогены, связанные с бензольным кольцом по ориентированному влиянию в реакциях SE относятся к ориентантам I рода, но, являясь электроно-акцепторными(-I>+M), они дезактивируют ядро, понижают скорость, как ориентанты II рода.
Лекция№9
