
- •Термодинамические процессы в идеальных газах
- •1. Изохорный процесс
- •Термодинамика процесса
- •Энтропия при изохорном процессе
- •2. Изобарный процесс
- •Теплоёмкость
- •Изменение энтропии
- •3. Изотермический процесс
- •4. Адиабатный процесс Основное уравнение термодинамики для адиабатического процесса
- •Работа газа
- •Внутренняя энергия идеального газа
- •Уравнение Пуассона
- •5. Политропный процесс
2. Изобарный процесс

График изобарического расширения газа от объёма Va до Vb. AB здесь является изобарой.
Изобарный процесс (др.-греч. ίσος, isos — «одинаковый» + άαρος, baros — «вес») — термодинамический процесс, происходящий в системе при постоянном давлении и массе идеального газа.Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе
![]() .
.
Работа, совершаемая газом при расширении или сжатии газа, равна A = PΔV.
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: δQ = ΔI = ΔU + PΔV.
Теплоёмкость
Молярная теплоёмкость при постоянном давлении обозначается как Cp. В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера Cp = Cv + R.
Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной:
-
для одноатомных газов
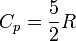 ,
то есть около 20.8 Дж/(моль·К);
,
то есть около 20.8 Дж/(моль·К); -
для двухатомных газов
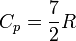 ,
то есть около 29.1 Дж/(моль·К);
,
то есть около 29.1 Дж/(моль·К); -
-
для многоатомных газов Cp = 4R, то есть около 33.3 Дж/(моль·К).
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Изменение энтропии
Изменение энтропии при квазистатическом изобарном процессе равно:
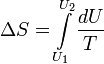
В случае, если изобарный процесс происходит в идеальном газе, то
dU = d(νCvT + νRT) = ν(Cv + R)dT = νCpdT, следовательно, изменение энтропии можно выразить как.
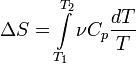
Если пренебречь зависимостью Cp от температуры, то.
![]()
3. Изотермический процесс
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
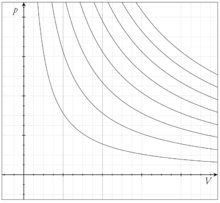
Несколько изотерм для идеального газа нa p-V диаграмме
Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
В идеальном газе при изотермическом процессе произведение давления на объём постоянно (закон Бойля-Мариотта). Изотермы идеального газа в координатах p,V — гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (см. рисунок).
При изотермическом процессе системе, вообще говоря, сообщается определённое количество теплоты (или она отдаёт теплоту) и совершается внешняя работа. Альтернативный процесс, при котором теплообмен с окружающей средой отсутствует (термодинамическая система находится в энергетическом равновесии — система не поглощает и не выделяет тепло), называется адиабатическим процессом.
Работа,
совершенная идеальным газом в
изотермическом процессе, равна
![]() ,
где
,
где
![]() —
число частиц газа,
—
число частиц газа,
![]() —
температура,
—
температура,
![]() и
и
![]() —
объём газа в начале и конце процесса,
—
объём газа в начале и конце процесса,
![]() —
постоянная
Больцмана .
—
постоянная
Больцмана .
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса в идеальном газе записывается в виде:
![]()
![]()
