
- •Термодинамические процессы в идеальных газах
- •1. Изохорный процесс
- •Термодинамика процесса
- •Энтропия при изохорном процессе
- •2. Изобарный процесс
- •Теплоёмкость
- •Изменение энтропии
- •3. Изотермический процесс
- •4. Адиабатный процесс Основное уравнение термодинамики для адиабатического процесса
- •Работа газа
- •Внутренняя энергия идеального газа
- •Уравнение Пуассона
- •5. Политропный процесс
Термодинамические процессы в идеальных газах
Термодинамика изучает пять основных процессов идеальных газов:
1. изохорный, (v= const) происходящий при постоянном объеме газа;
2. изобарный, (р = const) происходящий при постоянном давлении;
3. изотермический, (Т = const) происходящий при постоянной температуре;
4. адиабатный, (q = 0) протекающий без подвода или отвода теплоты, т.е. протекающий без теплообмена с окружающей средой;
5. политропный — обобщенный процесс изменения всех параметров рабочего тела при наличии теплообмена; для него четыре предыдущих процесса являются частными случаями.
1. Изохорный процесс
Изохорический или изохорный процесс (от др.-греч. ίσος — «равный», и χώρος — «пространство, занятое место») — это термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.При изохорическом процессе давление идеального газа прямо пропорционально его температуре. В реальных газах закон Шарля не выполняется.
На графиках изображается линиями, которые называются изохоры. Для идеального газа они являются прямыми во всех диаграммах, которые связывают параметры: T (температура), V (объем) и P (давление).
Термодинамика процесса
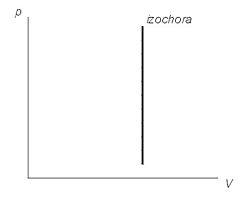
График изохорного процесса на диаграмме (P,V)
Из определения работы следует, что изменение работы при изохорном процессе равно:
![]()
Чтобы определить полную работу процесса проинтегрируем данное выражение. Поскольку объем неизменен, то:
![]() ,
,
Но такой интеграл равен нулю. Итак, при изохорном процессе газ работы не совершает:
![]() .
.
Графически доказать это намного проще. С математической точки зрения, работа процесса — это площадь под графиком. Но график изохорного процесса является перпендикуляром к оси абсцисс. Таким образом, площадь под ним равна нулю.Изменение внутренней энергии идеального газа можно найти по формуле:
![]() ,
,
где i — число степеней свободы, которое зависит от количества атомов в молекуле (3 для одноатомной (например, неон), 5 для двухатомной (например, кислород) и 6 для трёхатомной и более (например, молекула водяного пара)).
Из определения и формулы теплоёмкости и, формулу для внутренней энергии можно переписать в виде:
![]() ,
,
где
![]() —
молярная теплоёмкость при постоянном
объёме.
—
молярная теплоёмкость при постоянном
объёме.
Используя первое начало термодинамики можно найти количество теплоты при изохорном процессе:
![]()
Но при изохорном процессе газ не выполняет работу. То есть, имеет место равенство:
![]() ,
,
то есть вся теплота, которую получает газ идёт на изменение его внутренней энергии.
Энтропия при изохорном процессе
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует:
![]()
Выше была выведена формула для определения количества теплоты. Перепишем ее в дифференциальном виде:
![]() ,
,
где ν — количество
вещества,
![]() —
молярная
теплоемкостью при постоянном
объеме. Итак, микроскопическое изменение
энтропии при изохорном процессе можно
определить по формуле:
—
молярная
теплоемкостью при постоянном
объеме. Итак, микроскопическое изменение
энтропии при изохорном процессе можно
определить по формуле:
![]()
Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе:
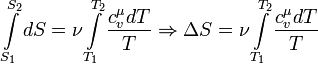
В данном случае выносить выражение молярной теплоемкости при постоянном объеме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры.
