
ДЗ – 2(2)
«Химическая кинетика и равновесие»
1 Примеры решения задач
-
Вычисление скорости химических реакций
Пример 1. Как запишется закон действия масс для реакции горения угля
С + O2 → СО?
Решение: В случае гетерогенных реакций в уравнения закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собою постоянную величину и поэтому входит в константу скорости.
W = k' · const · [O2] = k · [O2] , где k = k' · const.
Пример 2. Написать выражение закона действия масс для реакций
а) 2NO (г.) + Cl2 (г.) → 2NOCl (г.);
б) CaCO3 (к.) → СaO (к.) + CO2 (г.).
Решение: а) v = k[NO]2[Cl2] ;
б) Поскольку карбонат кальция – твердое вещество, концентрация которого не изменяется в ходе реакции, искомое выражение будет иметь вид v = k, т.е. в данном случае скорость реакции при определенной температуре постоянна.
Пример 3. Предскажите, как изменится скорость газовой реакции A + 2B + 3D → F при повышении общего давления в 3 раза.
Решение: Пусть W1–скорость при некотором первоначальном давлении рA, рB, рD: W1 = k рA рB2рD3.
Пусть
W2
– скорость при концентрациях
![]() .
Тогда
скорость возрастет:
.
Тогда
скорость возрастет:

Таким образом, увеличение общего давления в 3 раза приводит к увеличению парциальных давлений компонентов в то же число раз, что скажется в 729-кратном увеличении скорости.
Пример 4. Как изменится скорость реакции
2NO (г.) + O2 (г.) = 2NO2 (г.),
если уменьшить объем реакционного сосуда в 3 раза?
Решение: До изменения объема скорость реакции выражалась уравнением
v = k[NO]2[O2].
Вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастет в 3 раза. Следовательно,
v' = k(3[NO])2(3[O2]) = 27k[NO]2[O2].
Сравнивая выражения для v и v', находим, что скорость реакции возрастет в 27 раз.
1.2 Влияние температуры и природы веществ на скорость реакции
Пример 1. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 750С?
Решение: Поскольку Δt = 550С, то обозначив скорость реакции при 20 и 750С соответственно через v и v', можем записать:
v'/v = 2,855/10 =2,85,5; lg(v'/v) = 5,5lg2,8 = 5,5.0,447 = 2,458.
Отсюда v'/v = 287. Скорость реакции увеличится в 287 раз.
Пример 2. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 250С?
Решение: Обозначим энергию активации реакции без катализатора через Еа, а с катализатором – через Е′а; соответствующие константы скорости реакции обозначим через k и k'. Используя уравнение Аррениуса, находим:
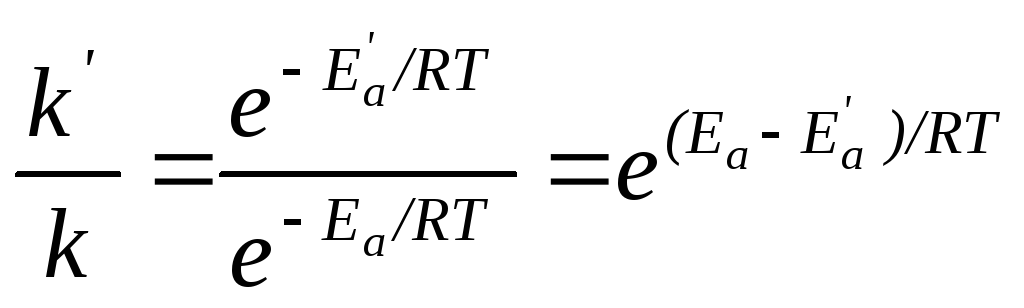 .
.
Отсюда:
![]() ;
;
![]()
Подставляя в последнее уравнение данные задачи, выражая энергию активации в джоулях и учитывая, что Т = 298 К, получим
![]()
Окончательно находим: k'/k = 2,5.104.
