
- •Лабораторная 2
- •Частота колебаний - количественная характеристика периодического колебательного процесса, равная числу полных колебаний, совершаемых в единицу времени.
- •Лабораторная 3
- •При абсолютно упругом ударе
- •Лабораторная 4
- •Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
- •Лабораторная 5
- •Лабораторная 6
- •Лабораторная 7
- •Лабораторная 8
- •Лабораторная 9
- •Лабораторная 10
-
удар (соударение, СТОЛКНОВЕНИЕ) - модель взаимодействия двух тел, длительность которого равна нулю (мгновенное событие). Применяется для описания реальных взаимодействий, длительностью которых можно пренебречь в условиях данной задачи.
-
-
АБСОЛЮТНО УПРУГИЙ УДАР - столкновение двух тел, после которого форма и размеры сталкивающихся тел восстанавливаются полностью до состояния, предшествовавшего столкновению. Суммарные импульс и кинетическая энергия системы из двух таких тел сохраняются (после столкновения такие же, какими были до столкновения)
-
При абсолютно упругом ударе
-
если сумма внешних сил, действующих на тела системы, равна нулю, то импульс системы сохраняется.
-
-
При абсолютно упругом ударе
-
кинетическая энергия системы из двух таких тел сохраняются (после столкновения такие же, какими были до столкновения)
-
Кинети́ческая эне́ргия — энергия механической системы, зависящая от скоростей движения её точек; энергия механического движения этого тела.
-
Потенциальная энергия - механическая энергия системы тел, определяемая их взаимным расположением и характером сил взаимодействия между ними
-
Полная механическая энергия - энергия механического движения и взаимодействия, т.е. равна сумме кинетической и патенциальной энергий
-
Замкнутая система тел в механике — совокупность физических тел, у которых взаимодействия с внешними телами и силами отсутствуют.
-
Замкнутая или изолированная система тел - система тел, которая не взаимодействует с окружающими телами.
-
При неупругом
-
При упругом
-
При неупругом
-
Прицельное расстояние d есть расстояние между линией движения первого шара и параллельной ей линией, проходящей через центр второго шара. Законы сохранения для кинетической энергии и импульса преобразуем и получим.
Лабораторная 4
-
СОСТОЯНИЕ системы имеет фиксированные значения макроскопических параметров, описывающих систему в целом. Параметры, характеризующие систему в целом, называются ПАРАМЕТРАМИ СОСТОЯНИЯ. Примерами являются температура, давление, объем и т.д.
-
РАВНОВЕСНЫМ называется такое состояние системы, при котором все параметры системы имеют определенные значения, остающееся неизменными сколь угодно долго при неизменных внешних условиях.
-
ОБРАТИМЫМ называется процесс, при реализации которого в обратном направлении система проходит через те же состояния, что и при прямом ходе, но в обратной последовательности. Равновесные процессы всегда обратимы.
-
КРУГОВЫМ процессом (ЦИКЛОМ) называется процесс, при котором система после ряда изменений возвращается в исходное состояние.
-
Уравнение состояния, связывает давление р, объём V и температуру Т физически однородной системы в состоянии равновесия термодинамического: f (p, V, Т) = 0
-
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
-
объём частицы газа равен нулю (то есть, диаметр молекулы
 пренебрежимо
мал по сравнению со средним расстоянием
между ними,
пренебрежимо
мал по сравнению со средним расстоянием
между ними,
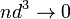 )
[1];
)
[1]; -
импульс передается только при соударениях (то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях);
-
суммарная энергия частиц газа постоянна (то есть, нет передачи энергии за счет передачи тепла или излучения)
-
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
-
ТЕПЛОЕМКОСТЬ тела численно равна отношению количества тепла d’Q, сообщенного телу, к изменению температуры тела dT, которое при этом произошло:
СТЕЛА
=
![]() .
.
-
УДЕЛЬНОЙ теплоемкостью вещества называется отношение теплоемкости к массе тела. Если тело нем меняет свой объем, то оно не совершает работы, поэтому при постоянном объеме тела переданное телу тепло dQ’ идет на изменение его внутренней энергии dU.
-
ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ОБЪЕМЕ
СV
=
![]() .
.
-
ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ идеального газа, молекулы которого имеют i степеней свободы
CP
=
![]() (1).
(1).
-
ЧИСЛО (количество) СТЕПЕНЕЙ СВОБОДЫ есть минимальное количество независимых координат, необходимых для однозначного описания положения молекулы в пространстве ИЛИ минимальное количество независимых движений, суперпозиция которых дает любое движение молекулы. Число степеней свободы для одноатомной молекулы -3 (поступательное движение в направлении трех координатных осей),
-
ОТНОШЕНИЕ
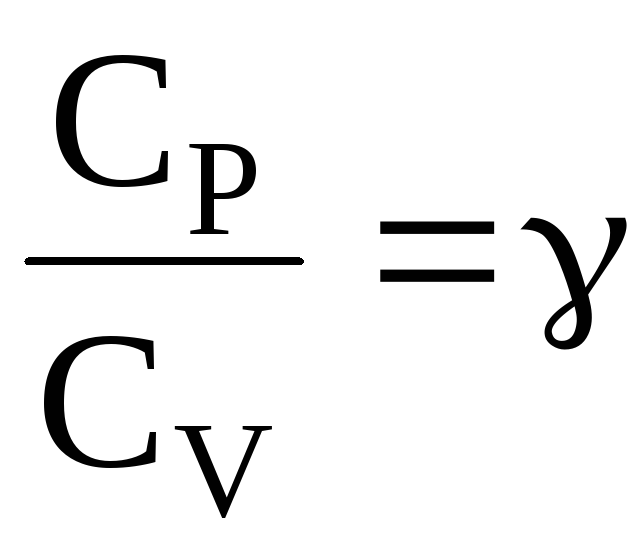 является константой (в определенном
диапазоне температур) для данного газа.
Эта константа называется показателем
адиабаты.
является константой (в определенном
диапазоне температур) для данного газа.
Эта константа называется показателем
адиабаты.
-
Формула
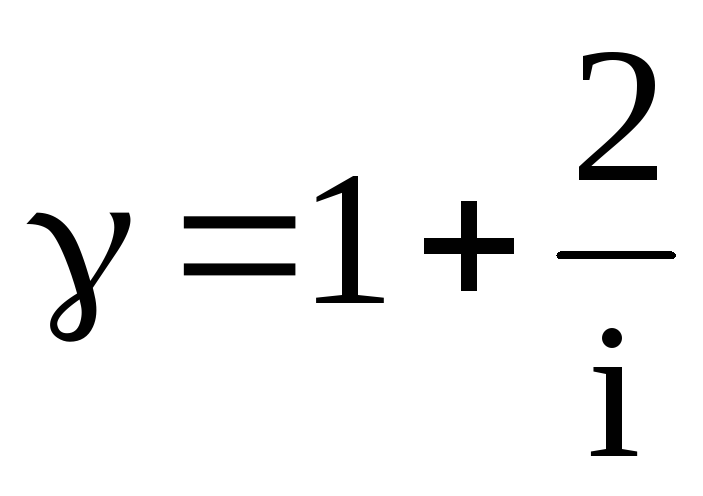 (2) устанавливает связь отношения
теплоемкостей
с числом
степеней свободы
молекулы газа i
.
(2) устанавливает связь отношения
теплоемкостей
с числом
степеней свободы
молекулы газа i
. -
АДИАБАТИЧЕСКИМ называется процесс, происходящий без теплообмена с внешней средой (d’Q = 0). Уравнение адиабаты
-
PV = const (3). Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
-
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс)
-
