
- •Контрольная работа 2.2
- •Тема 7. Растворы и дисперсные системы Оглавление
- •Тема 7. Растворы и дисперсные системы 1
- •Основные понятия и определения. Структура темы
- •Классификация растворов
- •Структура темы
- •Дисперсные системы (смеси) их виды
- •Грубодисперсные системы
- •Тонкодисперсные системы (коллоидные растворы)
- •Высокодисперсные системы (истинные растворы)
- •Концентрация, способы ее выражения
- •Растворимость веществ.
- •Способы выражения концентрации растворов.
- •Процентная
- •Молярная
- •Нормальная
- •Моляльная
- •Мольная доля
- •Физические законы растворов
- •Закон Рауля
- •Изменение температур замерзания
- •Изменение температур кипения
- •Закон Генри
- •Закон Вант-Гоффа. Осмотическое давление
- •Контрольная работа 3.1
- •Идеальные и реальные растворы.
- •Активность – концентрация для реальных систем
- •Теория растворов
- •Физическая теория
- •Растворение соли в воде
- •Химическая теория
- •Теория электролитической диссоциации
- •Растворы электролитов
- •Константа диссоциации
- •Степень диссоциации. Сильные и слабые электролиты
- •Электролитическая диссоциация воды
- •Ионное произведение воды
- •Водородный показатель. Кислотность и основность растворов
- •Кислотно-основные индикаторы
- •Окраска важнейших кислотно-основных индикаторов в различных средах
- •Реакции ионного обмена.
- •Образование слабого электролита
- •Выделение газа
- •Образование осадков
- •Условие образования осадка. Произведение растворимости
- •Гидролиз солей
- •Смещение равновесия при гидролизе
-
Степень диссоциации. Сильные и слабые электролиты
Кроме константы диссоциации силу электролита можно определить по значению другого параметра, зависящего от концентрации раствора. Таким параметром является кажущаяся степень диссоциации которая показывает долю молекул распавшихся на ионы.
Степень диссоциации ( ) - это отношение числа распавшихся на ионы молекул (Nдис.) к общему числу молекул растворенного вещества (Nобщ.):
![]() (7.6.4.)
(7.6.4.)
Степень диссоциации выражают в долях единицы или в процентах. Поскольку общее число молекул вещества в растворе пропорционально количеству его вещества и его молярной концентрации, то можно записать:
![]() (7.6.5.)
(7.6.5.)
где nдис. и cдис. - соответственно, количество и молярная концентрация растворенного вещества, подвергшегося электролитической диссоциации.
К сильным электролитам условно относят вещества, кажущаяся степень диссоциации которых в растворе превышает 30% ( > 0,3). При < 3% ( < 0,03) электролиты считают слабыми, в других случаях о них говорят как об электролитах средней силы.
Степень диссоциации обычно определяют по данным измерения электропроводности растворов, которая прямо пропорциональна концентрации свободно движущихся ионов. При этом получают не истинные значения , а кажущиеся значения. Они всегда меньше истинных значений , т.к. ионы при движении к электродам сталкиваются и частично уменьшают свою подвижность, особенно при высокой их концентрации в растворе, когда возникает электростатическое притяжение между ионами. Например, истинное значение степени электролитической диссоциации HCl в разбавленном растворе равно 1, в 1 М растворе = 0,78 (78%) при 180 С, однако, в этом растворе не содержится 22% недиссоциированных молекул HCl, практически все молекулы диссоциированы.
Электролиты, которые в разбавленном водном растворе диссоциируют практически полностью, называют сильными электролитами.
К сильным электролитам в водных растворах принадлежат почти все соли, многие неорганические кислоты (H2SO4, HNO3, HClO4, галогеноводородные, кроме HF и др.), гидроксиды s-элементов (исключение - Be(OH)2 и Mg(OH)2). Кажущиеся значения a этих электролитов находятся в пределах от 70 до 100%. Диссоциация сильных электролитов - это практически необратимый процесс:
HCl H+ + Cl- или HCl = H+ + Cl-
С точки зрения теории электролитической диссоциации кислоты - это вещества, диссоциирующие в водном растворе с образованием катионов водорода и анионов кислотного остатка, основания - это вещества, диссоциирующие в водном растворе с образованием гидроксид-ионов OH- и катионов металла.
Слабые многоосновные кислоты диссоциируют ступенчато. Каждую ступень характеризуют своим значением константы диссоциации, например:
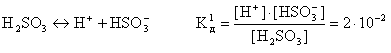
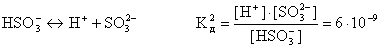
В связи со ступенчатой диссоциацией многоосновные кислоты способны образовывать кислые соли, NaHSO4, NaHCO3, K2HPO4 и т.д.
Слабые многокислотные основания диссоциируют ступенчато:
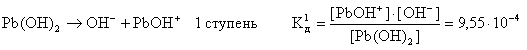

![]()
Этим объясняют способность многокислотных оснований образовывать основные соли: CuOHCl, (ZnOH)2SO4 и др.
Электролиты, которые в разбавленном водном растворе диссоциируют частично, называют слабыми. Диссоциация слабых электролитов - обратимый процесс
например:
|
|
(при 25 С) |
|
HCN H+ + CN- |
7·10-5 (или 0,007%) |
|
|
0,013 (или 1,3%) |
Степень электролитической диссоциации зависит от:
-
природы электролита и растворителя;
-
концентрации раствора;
-
температуры
и возрастает при увеличении разбавления раствора:
|
C(CH3COOH) , моль/л |
0,2 |
0,1 |
0,05 |
0,01 |
0,005 |
0,001 |
|
|
, % (при 25° С) |
0,05 |
1,4 |
1,9 |
4,2 |
6,0 |
12,4 |
|
|
|
слабый электролит |
электролит средней силы |
|||||
Степень диссоциации возрастает при увеличении температуры раствора. Увеличение кинетической энергии растворенных частиц способствует распаду молекул на ионы, что приводит к возрастанию степени диссоциации при нагревании растворов.
Если в растворе слабой кислоты или слабого основания увеличить концентрацию одноименного иона введением соответствующей соли, то наблюдается резкое изменение степени диссоциации слабого электролита. Рассмотрим, например, как изменится уксусной кислоты (CH3COOH) при введении в раствор ацетата натрия (введение одноименных ионов CH3COO-).
Согласно принципу Ле Шателье равновесие процесса диссоциации
![]()
сместится влево в результате увеличения концентрации ацетат-ионов CH3COO-, образующихся при диссоциации ацетата натрия:
CH3COONa CH3COO- + Na+.
Такое смещение равновесия в сторону образования CH3COOH означает уменьшение степени ее диссоциации и приводит к уменьшению концентрации ионов водорода, например:
|
C(CH3COOH), моль/л |
0,01 |
0,01 |
|
C(CH3COONa), моль/л |
|
0,01 |
|
[H+], моль/л |
4,32·0-4 |
1,86·10-5 |
Таким образом, в результате введения в 1 л 0,01 М раствора CH3COOH 0,01 моль CH3COONa концентрация ионов водорода уменьшилась в
![]() .
.
С точки зрения теории электролитической диссоциации амфотерные гидроксиды (амфолиты) - это вещества, диссоциирующие в водном растворе как по типу кислот, так и по типу оснований. К ним относят Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3, и др. Например, уравнения электролитической диссоциации Be(OH)2:
1) диссоциация по типу основания:
Be(OH)2 + 3H2O OH- + [BeOH(H2O)3]
[BeOH(H2O)3] + H2O OH- + [Be(H2O)4]
2) диссоциация по типу кислоты:
Be(OH)2 + 2H2O H+ + [Be(OH)3H2O]
[Be(OH)2H2O] H+ + [Be(OH)3]
-
Закон разведения Оствальда

Вильгельм Фридрих Оствальд (2.09.1853,—4.04.1932)— балтийский немец, физико-химик и философ-идеалист, лауреат Нобелевской премии по химии 1909 года. Член-корреспондент Петербургской АН (1895).
Между константой и степенью диссоциации существует определенная закономерность, которую в 1888 г. обнаружил В.Оствальд и сумел ее объяснить. Эта закономерность впоследствии была названа законом разведения Оствальда.
Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Kд связана с простой зависимостью. Если общую молярную концентрацию электролита в растворе обозначить СКА , то для бинарных электролитов концентрации ионов Ky+ и Ax- будут равны ·CKA . Очевидно, что
[Ky+] = [Ax-] = ·CKA ,
[KA] = CKA - ·CKA = CKA·(1- ), тогда
![]() (7.6.6.)
(7.6.6.)
Для слабых электролитов 0 и (1 - ) 1. Следовательно,
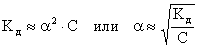 (7.6.7.)
(7.6.7.)
Полученная зависимость является математическим выражением закона разбавления Оствальда:
степень диссоциации слабого электролита увеличивается при разбавлении раствора обратно пропорционально корню квадратному из его молярной концентрации.
