
Состав атмосферы Способы выражения состава чистого и загрязненного воздуха Основные понятия и расчетные формулы
С позиций химии воздух можно рассматривать как газовый раствор – смесь равномерно распределенных друг в друге веществ. Поэтому при описании такой системы удобно использовать термины характерные для растворов. Любой компонент воздуха и загрязнитель (если последний представляет собой газ) будем называть растворенным веществом; чистый воздух, а также смесь воздуха и загрязнителей – раствором. В первом случае он состоит из азота, кислорода, инертных газов и необходимого количества других веществ. Во втором к этим компонентам добавляется один или несколько загрязнителей.
Предположим, что раствор состоит из нескольких компонентов: 1, 2, 3, ..., i, ..., n. Любая величина с индексом i относится к i-му растворенному веществу. Для выражения состава чистого и загрязненного воздуха чаще всего используются приведенные далее величины.
1. Количество частиц в 1 см3 раствора ni показывает, сколько частиц i -го растворенного вещества содержится в 1 см3 раствора.
Такими частицами для атмосферного воздуха могут быть молекулы, атомы, ионы, радикалы и электроны. Единица измерения количества частиц в 1 см3 раствора – 1/см3.
2. Массовая
концентрация
![]() равна массе растворенного вещества
равна массе растворенного вещества
![]() ,
отнесенной к объему раствора
,
отнесенной к объему раствора
![]() :
:
![]() .
(1.1)
.
(1.1)
Единица измерения массовой концентрации – кг/м3.
3. Массовая
доля
![]() – отношение массы i-го
растворенного вещества
– отношение массы i-го
растворенного вещества
![]() к массе раствора
к массе раствора
![]()
![]() .
(1.2)
.
(1.2)
Массовая доля – величина безразмерная. Она может быть выражена в долях единицы (формула (1.2)) или в массовых процентах (сокращенно % (масс.), формула (1.3))
![]() .
(1.3)
.
(1.3)
4. Объемная
доля
![]() – это отношение объема i
-го
растворенного вещества
– это отношение объема i
-го
растворенного вещества
![]() к объему раствора
к объему раствора
![]()
![]() .
(1.4)
.
(1.4)
Объемная доля является безразмерной величиной и выражается в долях единицы (формула (1.4)) или в объемных процентах (сокращенно % (об.), формула (1.5))
![]() .
(1.5)
.
(1.5)
5. Безразмерная
величина
![]() (от английского parts
per
million
– частей на миллион). Таким образом,
(от английского parts
per
million
– частей на миллион). Таким образом,
![]() показывает, сколько объемных частей
i-го
растворенного вещества приходится на
миллион таких же по объему частей
раствора.
показывает, сколько объемных частей
i-го
растворенного вещества приходится на
миллион таких же по объему частей
раствора.
Если
задаться объемом раствора 1 м3,
то для
![]() объем растворенного вещества будет
равен 1 см3
объем растворенного вещества будет
равен 1 см3
![]() .
(1.6)
.
(1.6)
Следует
отметить, что в данном пособии рассмотрены
лишь объемные
![]() .
Это связано с тем, что массовые
.
Это связано с тем, что массовые
![]() используются в литературе значительно
реже.
используются в литературе значительно
реже.
Обозначение
5 ppm
показывает, что в миллионе объемных
частей воздуха содержится 5 таких же по
объему частей газообразной примеси.
Для выражения состава раствора с помощью
![]() используется также и другое обозначение
– млн -1.
Запись 5 млн -1
аналогична 5 ppm.
используется также и другое обозначение
– млн -1.
Запись 5 млн -1
аналогична 5 ppm.
6. Безразмерная
величина
![]() .
Используется для очень малых концентраций
газообразных примесей в воздухе вместо
.
Используется для очень малых концентраций
газообразных примесей в воздухе вместо
![]() .
Название происходит от американского
parts
per
billion
– частей на миллиард (
.
Название происходит от американского
parts
per
billion
– частей на миллиард (![]() в Америке называется биллионом, а в
Европе – миллиардом).
в Америке называется биллионом, а в
Европе – миллиардом).
Следовательно,
![]() показывает, сколько объемных частей i
-го
растворенного вещества приходится на
миллиард таких же по объему частей
раствора.
показывает, сколько объемных частей i
-го
растворенного вещества приходится на
миллиард таких же по объему частей
раствора.
При
1
![]() в 1 м3
раствора
содержится 1 мм3
растворенного вещества
в 1 м3
раствора
содержится 1 мм3
растворенного вещества
![]() .
(1.7)
.
(1.7)
Обозначение 1 млрд -1 тождественно 1 ppb.
Пересчет состава раствора из одних единиц измерения в другие показан ниже.
1. Массовые концентрации и массовые доли.
Обозначим
массовые концентрации компонентов
раствора как
![]() ;
единица измерения – кг/м3.
Их сумма
;
единица измерения – кг/м3.
Их сумма
![]() равна массе одного кубического метра
раствора, а это не что иное, как плотность
раствора
равна массе одного кубического метра
раствора, а это не что иное, как плотность
раствора
![]() ,
кг/м3.
Таким образом, массовая доля любого
компонента может быть рассчитана через
его массовую концентрацию
,
кг/м3.
Таким образом, массовая доля любого
компонента может быть рассчитана через
его массовую концентрацию
![]() ,
которая представляет собой массу
растворенного вещества, содержащуюся
в одном кубическом метре раствора, по
следующей формуле:
,
которая представляет собой массу
растворенного вещества, содержащуюся
в одном кубическом метре раствора, по
следующей формуле:
![]() ,
(1.8)
,
(1.8)
и наоборот
![]() .
(1.9)
.
(1.9)
Поскольку
количество загрязнителей в воздухе
обычно много меньше количества самого
воздуха, то в этих случаях можно плотность
раствора принять равной плотности
воздуха. В приближении идеального газа
плотность воздуха при нормальных
условиях (температура
![]() ;
давление
;
давление
![]() )
равна отношению его молярной массы
)
равна отношению его молярной массы
![]() к молярному объему
к молярному объему
![]()
![]() ,
(1.10)
,
(1.10)
где
![]() (для сухого воздуха),
(для сухого воздуха),
![]() .
При условиях, отличных от нормальных
(другая температура Т
и давление р),
плотность воздуха вычисляется по формуле
.
При условиях, отличных от нормальных
(другая температура Т
и давление р),
плотность воздуха вычисляется по формуле
![]() .
(1.11)
.
(1.11)
2. Количества частиц в 1 см3 раствора и массовые концентрации.
Как
уже было сказано ранее, массовая
концентрация i-го
растворенного вещества
![]() в кг/м3
– это его масса в кг, содержащаяся в 1
м3
раствора. Тогда количество
i
-го
растворенного вещества в 1 см3
раствора –
в кг/м3
– это его масса в кг, содержащаяся в 1
м3
раствора. Тогда количество
i
-го
растворенного вещества в 1 см3
раствора –
![]() ,
где
,
где
![]() –
молярная масса i
-го
растворенного вещества, кг/моль .
Следовательно, количество частиц i
-го
растворенного вещества в 1 см3
раствора
–
молярная масса i
-го
растворенного вещества, кг/моль .
Следовательно, количество частиц i
-го
растворенного вещества в 1 см3
раствора
![]() связано с его массовой концентрацией
следующим образом
связано с его массовой концентрацией
следующим образом
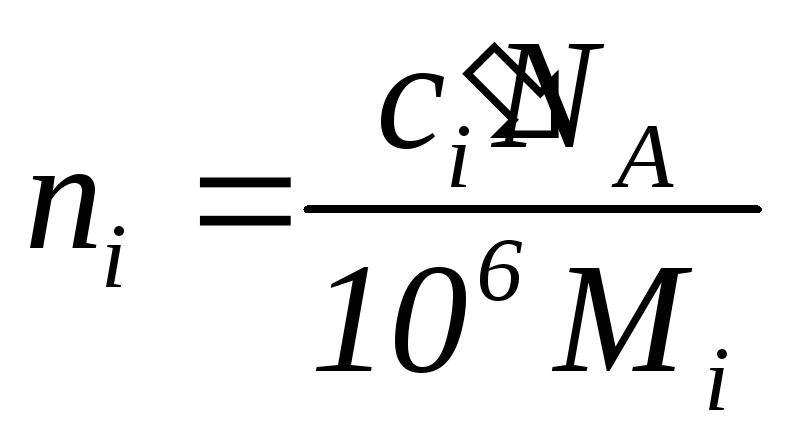 ,
(1.12)
,
(1.12)
где
![]() – постоянная Авогадро.
– постоянная Авогадро.
3. Массовые доли и объемные доли.
Преобразуем формулу (1.2), заменив массы произведениями соответствующих плотностей и объемов
![]() ,
(1.13)
,
(1.13)
где
![]() – плотность растворенного вещества.
Используя формулу (1.4), получим
– плотность растворенного вещества.
Используя формулу (1.4), получим
![]() (1.14)
(1.14)
или
![]() .
(1.15)
.
(1.15)
Если сделать допущение о том, что воздух и газовые примеси являются идеальными газами и использовать соотношение (1.11) вместе с аналогичным выражением для i -го компонента
![]() ,
(1.16)
,
(1.16)
то можно получить
![]() (1.17)
(1.17)
или
![]() .
(1.18)
.
(1.18)
4. Объемные
доли,
![]() и
и
![]() .
.
Исходя
из определений объемной доли,
![]() и
и
![]() ,
нетрудно записать связывающие их
соотношения
,
нетрудно записать связывающие их
соотношения
![]() ,
(1.19)
,
(1.19)
![]() ,
(1.20)
,
(1.20)
![]() ,
(1.21)
,
(1.21)
![]() ,
(1.22)
,
(1.22)
![]() .
(1.23)
.
(1.23)
5. Массовые концентрации и объемные доли.
Приравняв правые части уравнений (1.8) и (1.14), после сокращения получим
![]() .
(1.24)
.
(1.24)
6. Массовые
концентрации,
![]() и
и
![]() .
.
Выразив
![]() из уравнений (1.19) и (1.22) и подставив их
поочередно в уравнение (1.24), получим
из уравнений (1.19) и (1.22) и подставив их
поочередно в уравнение (1.24), получим
![]() ,
(1.25)
,
(1.25)
![]() .
(1.26)
.
(1.26)
Для идеального газа можно воспользоваться соотношением (1.16), подставив его в уравнения (1.25) и (1.26). Конечные формулы принимают вид
![]() ,
(1.27)
,
(1.27)
![]() .
(1.28)
.
(1.28)
7. Количества
частиц в см3,
![]() и
и
![]() .
.
Подставляя поочередно уравнения (1.27) и (1.28) в уравнение (1.12) и проводя сокращения, получим
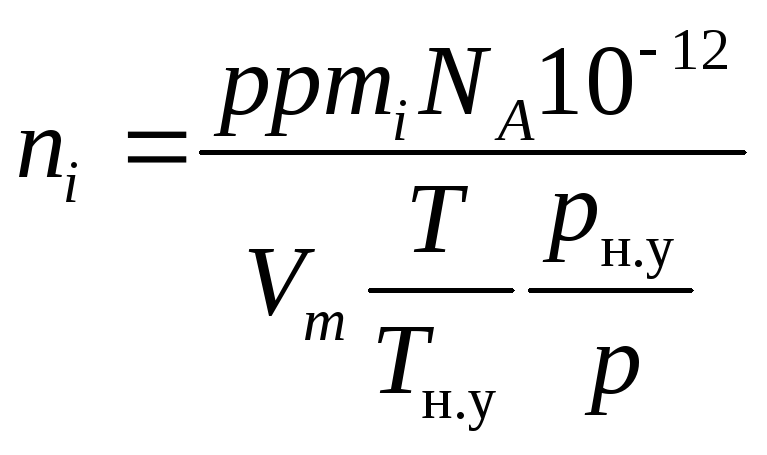 ,
(1.29)
,
(1.29)
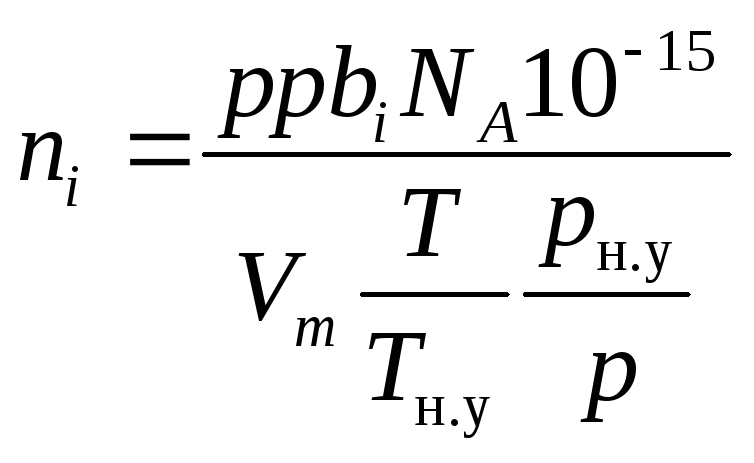 .
(1.30)
.
(1.30)
Такая форма представления позволяет учесть поправки на температуру и давление, которые приводят молярный объем идеального газа к условиям, отличным от нормальных.
О бозначив
стрелками ( ) выведенную связь,
допускающую взаимный перевод, между
двумя способами выражения состава
чистого и загрязненного воздуха, приведем
следующую схему
бозначив
стрелками ( ) выведенную связь,
допускающую взаимный перевод, между
двумя способами выражения состава
чистого и загрязненного воздуха, приведем
следующую схему

Безусловно,
можно было бы остановиться еще на ряде
формул, непосредственно связывающих
между собой вышеуказанные величины.
Однако не будем этого делать из
методических соображений, так как в
разделе уже даны соотношения, позволяющие
при любом способе выражения состава
рассчитать массовую концентрацию
![]() ,
а затем вычислить другую интересующую
величину (см. схему).
,
а затем вычислить другую интересующую
величину (см. схему).
