
- •Геохимия как наука Объекты изучения геохимии. Связь геохимии с другими науками
- •Формы нахождения химических элементов в земной коре
- •Изоморфизм
- •Изоструктурность
- •Геохимия седиментации Перенос вещества водными растворами в зоне гипергенеза
- •Общие закономерности осадкообразования
- •Геохимия гипергенных процессов
- •Форма нахождения химических элементов в зоне гипергенеза
- •Типы миграций
Изоструктурность
Если
компоненты обладают одинаковыми
параметрами кристаллической решетки,
близкими ионными радиусами, но имеют
различные типы химической связи,
изоморфные смеси они образовывать не
будут. Например, галенит
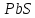 и галит
и галит
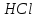 имеют практически одинаковую
кристаллическую решетку, близкие ионные
радиусы элементов, но ни при каких
условиях эти два минерала изоморфную
смесь не образуют, так как у них разные
типы химической связи.
имеют практически одинаковую
кристаллическую решетку, близкие ионные
радиусы элементов, но ни при каких
условиях эти два минерала изоморфную
смесь не образуют, так как у них разные
типы химической связи.
Изостркутурные компоненты – компоненты с одинаковыми структурами, но не образующие смешанного кристалла.
Элементы примесей в минералах и горных породах, их применение для решения геологических задач
Для решения вопросов геологии используется валовый состав примесных элементов. По содержанию примесных элементов минералы разделяются на две группы:
1. Минералы-концентраторы.
Отношение содержания элемента в минерале
к содержанию элемента в породе больше
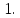 Главным образом представлены акцессорными
минералами (циркон, сфен, апатит).
Главным образом представлены акцессорными
минералами (циркон, сфен, апатит).
2. Минералы-носители.
Отношение содержания элемента в минерале
к содержанию элемента в породе меньше
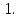 Главным образом представлены
породообразующими минералами.
Главным образом представлены
породообразующими минералами.
Иногда один и тот же минерал может быть и носителем и концентратором. Например, для свинца и бария и носителем, и концентратором является калиево-полевой шпат.
Примесные элементы используются для:
1. Корреляции массивов изверженных горных пород следующими методами:
-
Расчетом отношений содержания примесных элементов по результатам химических анализов; например
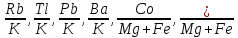 и т.д. Необходимо использовать только
те элементы, содержание которых в породе
непостоянное. Такие элементы как
молибден, германий.
и т.д. Необходимо использовать только
те элементы, содержание которых в породе
непостоянное. Такие элементы как
молибден, германий. -
Построением диаграмм (звездчатых, столбчатых, лепестковых) по результатам спектральных анализов.
2. Определения горных
пород, являющихся источником рудного
вещества, образовавшегося в результате
выщелачивания примесного элемента. В
горных породах рассеяно большое
количество примесных элементов (например,
в 1 км3 гранита содержится 230 млн
т.
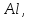 130 млн. т.
130 млн. т.
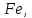 260 тыс. т.
260 тыс. т.
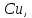 60 тыс. т., 260 тысяч тонн
60 тыс. т., 260 тысяч тонн
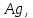 26 кг
26 кг
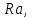 80000 тонн
80000 тонн
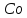 ,
100000 тыс. т.
,
100000 тыс. т.
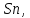 150 тыс. тонн
150 тыс. тонн
 12 тыс. т.
12 тыс. т.
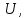 13 тонн
13 тонн
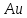 ,
13 тонн
,
13 тонн
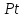 .
При решении этого вопроса обращается
внимание на форму вхождения примесного
элемента в кристаллическую решетку
минерала, на характер распределения и
содержание элемента в материнской
горной породе.
.
При решении этого вопроса обращается
внимание на форму вхождения примесного
элемента в кристаллическую решетку
минерала, на характер распределения и
содержание элемента в материнской
горной породе.
3. Установления генетической связи оруденения с конкретным массивом. Используются сквозные (проходящие) элементы, т.е. такие, которые являются одинаковыми и постмагматических образований. При выделении сквозных элементов учитывается характер их распределения в горной породе.
4. Определения генезиса минералов или горных пород. Например, существуют два генетических типа серпентинитовых массивов. Первый тип – результат гидротермальной переработки массивов ультраосновных пород, второй – результат гидротермального изменения доломитовых толщ. При этом для первого характерно содержание хромшпинеллидов, титановых руд, а второй тип не содержит оруденения. Типы различаются по примесным элементам: первый содержит никеля более 100 грамм на тонну, а также хром, кобальт, скандий; второй содержит никеля менее 100 грамм на тонну.
Миграция химических элементов
Атомы химических элементов
находятся в постоянной миграции. Этот
процесс противоречивый: с одной стороны
он приводит к концентрации химического
элемента в одной части земной коры и к
его дефициту с другой. Например, марганец
в эндогенных условиях рассеивается и
входит в состав кристаллических решеток
породообразующих минералов. В экзогенных
условиях образуются окислы и гидроокислы
марганца, происходит его концентрация,
а при попадании в глубинные условия
вновь происходит рассеивание марганца.
Миграция химических элементов может
происходить в атомной (например,
благородные газы), ионной (в виде части
растворов), молекулярной (в виде растворов
или расплавов) и грубодисперсной (в виде
обломков минералов или горных пород)
формах. По характеру среды миграции
может осуществляться в газообразном,
жидком и твердом состояниях (в результате
диффузии атомов через кристаллические
решетки минералов со скоростью 1 км/1,5
млрд. лет). По скорости миграции различают
активные мигранты
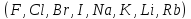 и пассивные мигранты
и пассивные мигранты
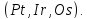
Факторы миграции химических элементов:
1. Внутренние (обусловлены особенностями строения атомов).
-
Ионный потенциал – отношение заряда иона к его радиусу. В зависимости от ионного потенциала меняется характер миграции химических элементов: элементы с ионным потенциалом <3 мигрируют в виде истинных растворов, элементы с ионным потенциалом от
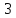 до
до
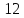 мигрируют в виде тонких взвесей, а с
ионным потенциалом больше
мигрируют в виде тонких взвесей, а с
ионным потенциалом больше
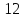 в виде истинных растворов в комплексных
соединениях.
в виде истинных растворов в комплексных
соединениях. -
Гравитационные свойства атомов. Проявляются в дифференциации вещества по атомной массе. Происходит дифференциация магматического расплава, обломочного материала, продуктов физического выветривания. Гравитационные свойства в процессе миграции не имеют абсолютного значения.
-
Термические свойства атомов. Проявляются в противодействии атомов или их соединений внешнему воздействию, направленному на их разъединение путем сообщения тепловой энергии (переход в жидкое или газообразное состояние). Для тех химических элементов, у которых температура испарения меньше
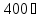 градусов, миграция в газообразном
состоянии имеет основное значение. Для
элементов от
градусов, миграция в газообразном
состоянии имеет основное значение. Для
элементов от
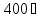 до
до
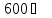 миграция
в газообразном состоянии имеет заметную
роль. А для тех, у кого выше
миграция
в газообразном состоянии имеет заметную
роль. А для тех, у кого выше
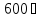 ,
такая миграция заметной роли не играет.
,
такая миграция заметной роли не играет. -
Свойства химической связи. При взаимодействии атомы образуют различные типы химической связи. В процессе взаимодействия атомы химических элементов образуют различные типы химической связи. Изменения типа химической связи определяют характер миграции химических элементов.
-
Радиоактивные и электрические свойства атомов влияют на миграцию элементов, но их роль слабо изучена.
2. Внешние (характеризуют среду миграции).
Температура. Наиболее важно значение имеют перепады температур среды, в частности, понижение. Это приводит к гидратации вещества, повышению подвижности CO2, понижению изоморфной смесимости компонентов. Температура варьируется в широких пределах. На Земле температура меняется от 1500-1600 (в магматических расплавах) до -80. Геотермический градиент: 1 градус на 30 м. В вулканических областях – 1 градус на 6 м; на щитах – 1 градус на 50 м. Для определения температур используются разнообразные методы:
Изотопная термометрия.
Структура распада.
Состав изоморфных смесей.
Полиморфные превращения минералов.
Температура плавления вещества (как максимальный термометр).
Использование типоморфных особенностей минералов.
По включениям в кристаллах.
Давление. При повышении давления повышается температура плавления вещества, препятствует развитию реакций с выделением газообразной фазы, благоприятствуют вхождению в кристаллические решетки ионов меньшего радиуса. Давления колеблются в широких пределах. Геобарический градиент: 275 атмосфер на 1 км. В центральных частях земли давлние достигает 3*10^6 атм.
Концентрация вещества K определяет законом действющих масс.

Изменение концентрации любого вещества, участвующего в реакции, всегда нарушает равновесие.
Источники энергии геологических процессов
-
Гравитационная – обусловлена гравитационным полем Земли. С глубиной гравитационная энергия растет до глубины 2900 км, а далее падает до нуля. Благодаря гравитации происходит пенепленизация поверхности Земли, дифференциация обломочных горных пород, магматических расплавов по массе. Гравитационная энергия может превратиться в тепловую.
-
Космическая (преимущественно, энергия Солнца). Энергия, достигшая Земли, поглощается земной корой, совершает работу и уходит в космос. Была разработана гипотеза аккумуляции солнечной энергии кристаллическими решетками алюмосиликатов: в эндогенных процессах при высоких температурах и давлениях образуются алюмосиликаты, в которых расстояние между ионами алюминия и кислорода составляет
 нм. При попадании этих минералов на
земную поверхность образуются
алюмосиликаты с расстоянием уже в
нм. При попадании этих минералов на
земную поверхность образуются
алюмосиликаты с расстоянием уже в
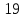 нм. Образование такой кристаллической
решетки требует поглощение энергии.
При попадании минералов на глубину
решетка вновь перестраивается, и
расстояние становится
нм. Образование такой кристаллической
решетки требует поглощение энергии.
При попадании минералов на глубину
решетка вновь перестраивается, и
расстояние становится
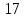 нм, а структурная перестройка
сопровождается выделением энергии.
нм, а структурная перестройка
сопровождается выделением энергии.
-
Энергия радиоактивного распада. Количество энергии в разные периоды Земли, выделяемой при радиоактивном распаде, было неодинаковым. Например, 4 млрд. лет назад
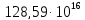 ккал/час; 3 млрд лет назад –
ккал/час; 3 млрд лет назад –
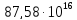 ккал/час… настоящее время –
ккал/час… настоящее время –
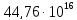 ккал/час. По расчетам этих трех источников
энергии достаточно для объяснения всех
геологических процессов. Возможно, что
где-то в недрах Земли есть другие, еще
не известные, источники энергии.
ккал/час. По расчетам этих трех источников
энергии достаточно для объяснения всех
геологических процессов. Возможно, что
где-то в недрах Земли есть другие, еще
не известные, источники энергии.
Кислотность среды –
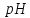 – определяется концентрацией ионов
водорода. При
– определяется концентрацией ионов
водорода. При
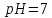 раствор нейтрален,
раствор нейтрален,
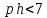 – раствор кислый,
– раствор кислый,
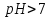 – раствор щелочной. В эндогенных
процессах повышение кислотности
благоприятствует замещению сильных
оснований более слабыми. Повышение
щелочности сопсобствует замене слабых
оснований более сильными (окварцевание,
альбитизация КПШ), и наоборот
(микроклинизация). В экзогенных и
гидротермальных процессах при повышении
кислотности образуется каолинит, при
повышении щелочности – монтмориллонит.
– раствор щелочной. В эндогенных
процессах повышение кислотности
благоприятствует замещению сильных
оснований более слабыми. Повышение
щелочности сопсобствует замене слабых
оснований более сильными (окварцевание,
альбитизация КПШ), и наоборот
(микроклинизация). В экзогенных и
гидротермальных процессах при повышении
кислотности образуется каолинит, при
повышении щелочности – монтмориллонит.
Окислительно-восстановительный
потенциал –
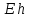 – используется для характеристики силы
окислителя и восстановителя. Выделяют
два типа реакций: обмена (валентность
элементов не меняется) и
окислительно-восстановительные
(валентности элементов меняются):
– используется для характеристики силы
окислителя и восстановителя. Выделяют
два типа реакций: обмена (валентность
элементов не меняется) и
окислительно-восстановительные
(валентности элементов меняются):
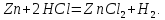 В природе преобладают
окислительно-восстановительные реакции.
В них выделяют окислитель и восстановитель.
В зависимости от условий один и тот же
элемент может быть как окислителем так
и восстановителем. Наиболее сильные
окислители:
В природе преобладают
окислительно-восстановительные реакции.
В них выделяют окислитель и восстановитель.
В зависимости от условий один и тот же
элемент может быть как окислителем так
и восстановителем. Наиболее сильные
окислители:
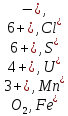
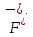 Наиболее сильные восстановители:
Наиболее сильные восстановители:
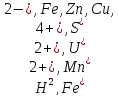 органическое вещество. Сумма окислителя
и восстановителя называется
окислительно-восстановительным
элементом, каждый в отдельности –
полуэлемент. За нулевой потенциал
принята реакция ионизации водорода.
Полуэлементы с
органическое вещество. Сумма окислителя
и восстановителя называется
окислительно-восстановительным
элементом, каждый в отдельности –
полуэлемент. За нулевой потенциал
принята реакция ионизации водорода.
Полуэлементы с
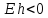 – восстановители, и наоборот. Если в
реакции участвуют только два восстановителя
с разными значениями
– восстановители, и наоборот. Если в
реакции участвуют только два восстановителя
с разными значениями
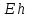 ,
то реакция идти будет, но при этом из
двух восстановителей более сильный
останется восстановителем, а более
слабый станет окислителем, и наоборот.
Пользуясь таблицами
,
то реакция идти будет, но при этом из
двух восстановителей более сильный
останется восстановителем, а более
слабый станет окислителем, и наоборот.
Пользуясь таблицами
 можно определить запрещенные и возможные
валентные состояния химических элементов.
Каждый полуэлемент является окислителем
для тех, у которых
можно определить запрещенные и возможные
валентные состояния химических элементов.
Каждый полуэлемент является окислителем
для тех, у которых
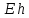 меньше, чем
меньше, чем
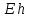 этого элемента, и наоборот.
этого элемента, и наоборот.
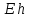 зависит от
зависит от
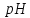 :
с повышением
:
с повышением
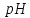 на
1
на
1
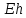 уменьшается на
уменьшается на
 вольт, т.е. в щелочной среде
окислительно-восстановительные процессы
проходят легче. Для определения условий
окисления-восстановления используются
валентные состояния железа: присутствие
минералов двухвалентного железа
указывает на восстановительную среду,
трехвалентного – на окислительную
среду. Восстановительную среду
характеризуют сульфиды, окислительную
– карбонаты, сульфаты, фосфаты, арсенаты,
ванадаты, бораты.
вольт, т.е. в щелочной среде
окислительно-восстановительные процессы
проходят легче. Для определения условий
окисления-восстановления используются
валентные состояния железа: присутствие
минералов двухвалентного железа
указывает на восстановительную среду,
трехвалентного – на окислительную
среду. Восстановительную среду
характеризуют сульфиды, окислительную
– карбонаты, сульфаты, фосфаты, арсенаты,
ванадаты, бораты.
Фильтрационный эффект
При движении раствора через однородную породу происходит отставание растворенного вещества от растворителя. По мере миграции в породе, выполняющей роль фильтра, происходит накопление растворенного вещества. Если концентрация превысит предел растворимости, то в фильтре начнется отложение вещества.
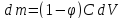
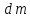 – количество вещества, откладывающегося
на фильтре;
– количество вещества, откладывающегося
на фильтре;
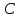 – концентрация раствора; dV
– объем раствора, проходящего через
фильтр; Фи – коэффициент фильтрационного
эффекта, равный
– концентрация раствора; dV
– объем раствора, проходящего через
фильтр; Фи – коэффициент фильтрационного
эффекта, равный
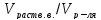 .
.
Благодаря фильтрационному эффекта вокруг любого тела (в том числе и рудного) образуется ореол, в составе которого находятся те же элементы, что сформировали данное тело. Поэтому выделяют первичные и вторичные ореолы.
Первичные ореолы эндогенные, связанные с образованием тела. Вторичные ореолы образуются при выветривании минеральных тел. Они могут быть водными, солевыми, обломочными. На изучении ореолов основана часть геохимических методов поиска месторождений полезных ископаемых: литогеохимические, гидрогеохимические и др.
Сорбционные свойства коллоидных систем
Коллоидный раствор представляет собой гетерогенную систему, состоящую из дисперсионной среды (выступает в роли растворителя) и дисперсной фазы (растворенное вещество), которые могут находится в любом состоянии (твердом, жидком, газообразном). Частицы дисперсной фазы называются мицеллами (от 1 до 100 микрон). Растворы, с размером частиц меньше микрона, истинные; крупнее 100 микрон – дисперсные взвеси. По соотношению дисперсионной среды и дисперсной фазы среди коллоидов выделяют золи и гели. В золях дисперсионной среда преобладает над дисперсной фазой, в гелях – наоборот. Выделяют гидрозоли (дисперсионная среда – вода) и аэрозоли (дисперсионная среда – газ). В коллоидах все мицеллы имеют одинаковый электрический заряд и, отталкиваясь друг от друга, могут находиться во взвешенном состоянии бесконечно долго. Но если электрические заряды нейтрализуются, мицеллы начинают притягиваться друг к другу, «слипаться» и золь переходит в гель – коагуляция. Возможен и обратный переход – пептизация – переход геля в золь в органических коллоидах. Коагуляция золей обусловлена следующими причинами:
-
перемешивание золей, мицеллы которых несут противоположный заряд;
-
попадание раствора в среду, богатую электролитами (например, морская вода);
-
спонтанная коагуляция – потеря дисперсионной среды (например, при интенсивном испарении);
-
биологический фактор.
Т.к. мицеллы имеют заряд, они способны поглощать химические элементы из среды. При этом если поглощенный элемент располагается на поверхности мицелл, то это процесс называется адсорбцией; если внутрь – абсорбция. И тот, и другой процесс называется сорбцией.
Коллоидные растворы распространены в природе, участвуют во всех эндо- и экзогенных процессах. Например, грязи, илы, почвы.
Коагулированный гель испытвает старение: дегидратация (например, опал переходит в халцедон), происходит раскристаллизация геля.
Формы переноса вещества. Комплексные соединения и их роль.
Вещество может переносится истинными
и коллоидными растворами. Истинные
растворы обладают высокой устойчивостью,
могут переносить вещество на большие
расстояния, но концентрация этих
растворов очень низкая. Коллоидные
растворы могут иметь большую концентрация,
но они неустойчивые, легко коагулируют.
Перенос вещества объясняется истинными
расторами комплексных соединений.
Тяжелые металлы являются
комплексообразователями (чаще всего
это анион) и получются такие соединения
как
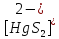 - ацидокомплекс. Во внешнюю часть
комплекса входят, например, щелочные
металлы.
- ацидокомплекс. Во внешнюю часть
комплекса входят, например, щелочные
металлы.
Гетерокомплексы. В их внутреннюю часть кромме анионной группы входит OH- (гидроксокомплекс) или H2O (аквакомплексы). Комплексные соединения обладают высокой растворимостью, и их истинные растворы характеризуются устойчивостью, высокой концентрацией растворенного вещества. Распад раствора комплексных соединений обуславливается изменением темературы, давления, pH или Eh среды. При этом распад комплекса может происходит сразу (одномоментно) или в несколько стадий.
Причины отложения вещества.
Геохимические барьеры
Отложение вещества обусловлено тем, что раствор попадает в область геохимического барьера. Геохимические барьеры – участки, в пределах которых резко замедляется скорость миграции химических элементов. В пределах барьера увеличивается концентрация растворенного вещества, а при превышении предела растворимости начинается его отложение. Барьеры объединяются в три группы:
Физические барьеры:
термодинамический – связан с резким изменением температуры и/или давления;
барьер фильтрационного эффекта;
структурный – раствор попадает в геологические структуры, благоприятные для накопления отложения (например, замковые части складок, флексуры).
Физико-химические барьеры:
Окислительный (кислородный) – раствор попадает в среду, богатую кислородом, что приводит к окислению и отложению вещества.
Восстановительный:
сероводородный;
безсероводородный.
Щелочной барьер.
Кислотный барьер.
Гидратационный барьер – в результате взаимодействия воды раствора с минералами содержание воды уменьшается, повышается концентрация раствора.
Сорбционный барьер.
Коагуляционный барьер.
испарительный барьер – характерен для экзогенных процессов.
Биологические барьеры.
Для установления форм перенос и условия отложения вещества используются следующие критерии:
1. Характер изменения вмещающих околожильных пород.
2. Характерные ассоциации минералов, образующихся при отложении вещества.
3. изменение парагенезиса минералов.
4. Появление минералов, облик кристаллов которых зависит от состава раствора.
5. Наличие или отсутствие типоморфных примесных элементов.
Геохимия геологических процессов
Термодинамическая направленность геологических процессов. Принцип Ле-Шателье.
Физико-химическая система – часть природной среды.
Q=Qсвоб.+Qсвяз.
Qсвяз – энергия, присущая данной системе, Qсвоб. - .
Если система лишена свободной энергии, то такие системы называют равновесными.
Если на равновесную систему воздействует внешний фактор, направленный на нарушение равновесия, то в системе развивается процесс, направленный на ослабление или нейтрализацию этого фактора.
Магматический процесс
Наиболее распространены базиты и гранитоиды.
Разнообразие базитов объясняется следующими причинами:
1. Кристаллизационная дифференциация единого по химизму базитового расплава, который поступает из базальтового слоя Земли.
2. Базитовая магма поступает по глубинным разломам с разных горизонтов базальтового слоя, поэтому состав базитов различен.
Третья точка зрения о формировании гранитов:
Граниты формируются за счет осадочных пород под воздействием сквозь магматических флюидов, которые выносят тепло, щелочи.
Разнообразие гранитоидов объясняется следующими причинами:
1. Ликвация расплава.
2. В результате кристаллизации образуются гибридные породы.
расплав расслаивается по удельным весам компонентов. Вверху накапливаются кислые по составу части расплава, внизу – ультраосновные.
4. Кристаллизационная дифференциация подчиняется правилу Боуэна, составившего схему выделения минералов (рис. 1). Левый ряд реакционный – каждый последующий минерал образуется после реакции уже выделившегося минерала с остаточным расплавом. Правый ряд – непрерывный, происходит постепенная эволюция состава. Порядок образования минералов определяется объемом ячейки кристаллической решетки.
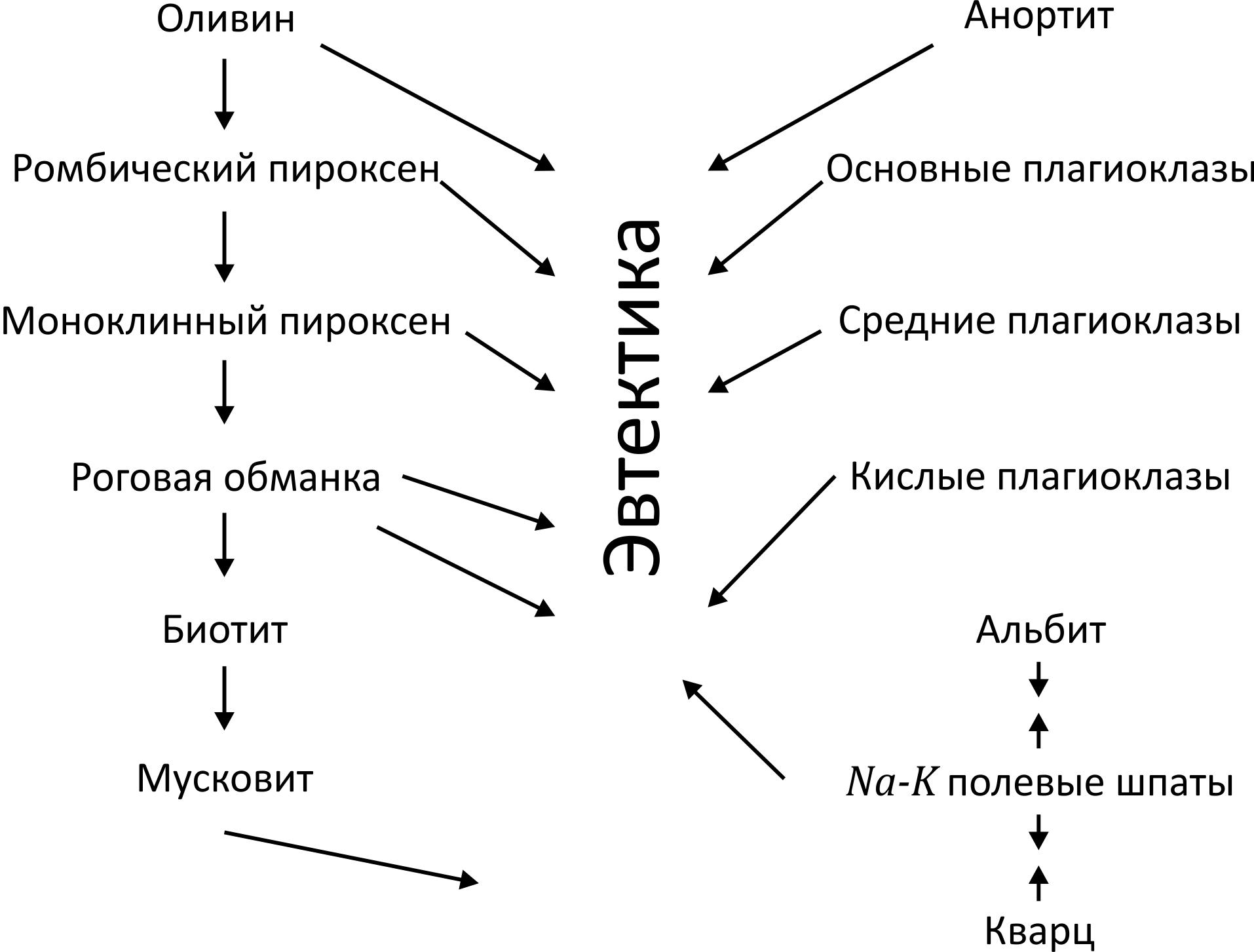
Формирование магматических пород подчиняется следующим закономерностям:
1. Содержание
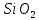 по мере формирования изверженных пород
увеличивается.
по мере формирования изверженных пород
увеличивается.
2. В левом ряду происходит закономерное изменение оснований: раньше всех из расплава уходит Mg, потом Fe, Mg, Ca. Между соседними элементами наблюдаются изоморфные замещения, а крайние основания (Ca и Mg) образуют двойную соль. В правом ряду раньше всех уходит из расплава Ca, затем Na и K.
3. По мере кристаллизации возрастает количество летучих компонентов и воды, поэтому количество водосодержащих минералов также увеличивается к концу магматического процесса.
4. Окислительно-восстановительные условия в магме характеризуются невысокими значениями Eh, но эти условия зависит от кислотности-щелочности. В кислых магмах величина Eh значительно выше, чем в щелочных. В базитовых магмах обстановка восстановительная, в щелочных расплавах значения Eh низкие, процессы окисления протекают легче.
5. Поведение редких элементов зависит от их кристаллохимических свойств: они не накапливаются в минералах, а уходят в пегматитовый или даже в гидротермальный раствор. Поведение Cu, Co, Ni, Hg обуславливается наличием S2: если она есть – элементы образуют сульфидную минерализацю, если нет – они накапливаются в более поздних пегматитовых расплавах. Редкие элементы, свойства которых близки к породообразующим элементам, рассеиваются в кристаллических решетках породообразующих минералов.
Пегматитовый процесс
Процесс тесно связан с магматическим. Существуют три основных гипотезы формирования пегматитов:
1. Пегматитовый расплав – это остаточный силикатный расплав после магматического процесса, обогащенный Na, K, Si, Al, TR, летучими компонентами. Разнообразие пегматитов обуславливается содержанием редких элементов в остаточном расплаве.
2. В результате кристаллизации остаточного силикатного расплава образуется только кварц-полевошпатовый агрегат, а все редкие минералы связаны с наложенным гидротермальным процессом.
3. Остаточного расплава не существует. Образование пегматитов обусловлено перекристаллизацией исходных пород под действием постмагматических метасоматических флюидов.
В настоящее время наиболее распространены первая и последняя гипотезы. Пегматиты образуются со всеми группами изверженных горных пород. Они наиболее характерны для гранитных и щелочных комплексов.
Для пегматитов характерно большое разнообразие минералов. Химические элементы в пегматитах можно разделить на пять групп:
1. Ведущие: Be, O2, Si, H2, Li, Al.
2. Главные: B, F, P.
3. Нормальные: He, Cl, Ca, Ti, Mo.
4. Случайных: Mg, Fe, Cr.
5. Запрещенные: Co, Ni, As.
К основным особенностям химизма пегматитов относятся следующие:
1. Преимущественное развитие нечетных химических элементов.
2. В пегмтаитха сочетаются контрастные химические элементы: легкие и тяжелые.
3. В составе пегматитов принимают участие химические элементы, попавшие из магматического расплава.
4. Особую роль играют Al и Si: Al замещает Si, что требует компенсации одного заряда из-за этого в кристаллические решетки вовлекаются одновалентные катионы Rb, Tl, Cs. Si легко сорбирует редкие элементы, а в момент кристаллизации сбрасывает их, и они образуют самостоятельные минералы. Если в расплаве невысокое содержание кремния, то редкие элементы рассеиваются в кристаллических решетках породообразующих минералов. Be в кислых породах сорбируется кремнеземом, в результате образует берилл. В щелочных породах кремнекислоты очень мало, поэтому весь бериллий рассеивается в кристаллических решетках минералов.
5. Образование месторождений пегматитового генезиса подчиняется правилу: месторождения образуются в тех случаях, когда в пегматитах нет минералов, в состав которых мог бы войти данный химический элемент, то элемент в них рассеивается.
Магматическая вода появляется в процессе кристаллизации магмы.
Захороненная вода поровых растворов осадочных горных пород.
Метеорные воды – поверхностные воды, проникающие в глубокие горизонты и там нагреваются и попадают в сферу действия гидротермальных процессов. При высоком давлении перегретые водные растворы действуют в области пониженного давления. Тектонические процессы способствуют образованию трещин, по которым растворы будут мигрировать далеко от магматического очага.
Кроме давления и температуры кристаллизацию вызывают следующие причины:
1. Потеря растворителя вследствие химических реакций раствора с вмещающими породами.
2. Химические взаимодействия раствора с вмещающими породами сопровождается изменением pH.
3. Разрушение комплексных соединений.
4. Потеря раствором газообразных составляющих (CO2).
5. Коагуляция коллоидных растворов.
6. Фильтрационный эффект.
Относительно состава первичных гидротермальных растворов прямые данные получить очень сложно. Из анализа жидких включений в минералах можно сделать вывод о высокой минерализации гидротермальных растворов, и общая минерализация достигает 20%, иногда до 50%, что связано с присутствием хлоридов, карбонатов, боратов,
