
- •Федеральное агенство по образованию
- •130201 - «Геофизические методы поисков разведки месторождений»
- •130504 – «Бурение нефтяных и газовых скважин»;
- •Тема: Механическое движение. Относительность движения. Система отсчета. Элементы кинематики материальной точки.
- •Тема: Преобразования координат Галилея. Классический закон сложения скоростей.
- •Тема: Механический принцип относительности. Скорость света. Постулаты Эйнштейна.
- •1. Пространство и время.
- •4. Следствия сто.
- •Релятивистский закон сложения скоростей
- •6. Релятивистская динамика. Связь между массой и энергией
- •Тема: Основная задача динамики. Сила. Масса. Законы ньютона. Закон всемирного тяготения. Гравитационное поле. Вес и невесомость.
- •Тема. Основные положения мкт. Размеры и масса молекул. Количество вещества. Опыт Штерна. Распределение молекул по скоростям.
- •Тема. Идеальный газ. Давление газа. Понятие вакуума. Основное уравнение идеального газа. Абсолютная температура.
- •1. Идеальный газ. Параметры состояния идеального газа.
- •2. Давление газа. Манометры.
- •3. Понятие о вакууме. Межзвездный газ.
- •1 Уравнение состояния идеального газа
- •2 Вывод уравнения состояния газа с переменными параметрами: массы, объема, давления и температуры.
- •Изопоцессы и их графики
- •5 Термодинамическая шкала температур. Абсолютный нуль.
- •Тема. Внутренняя энергия тела. Теплообмен и его виды. Уравнение теплового баланса. Первое начало термодинамики. Адиабатный процесс. Применение первого закона термодинамики.
- •1. Молекулярно-кинетический смысл температуры.
- •2. Что изучает термодинамика?
- •6. Применение I начала термодинамики к изопроцессам.
- •Тема. Второй закон термодинамики. Принцип действия тепловой машины. Кпд теплового двигателя. Охрана окружающей среды.
- •1. Обратимые и необратимые тепловые процессы.
- •2. Второе начало термодинамики.
- •3. Принцип действия тепловой машины. Кпд теплового движения.
- •Тема. Понятие фазы вещества. Насыщенный и ненасыщенный пар. Влажность воздуха. Точка росы. Кипение. Критическое состояние вещества. Сжижение газа.
- •6. Взаимодействие атмосферы и гидросферы.
- •7. Абсолютная и относительная влажность воздуха. Точка росы.
- •Тема. Кипение. Критическое состояние вещества. Сжижение газа.
- •1. Кипение. Зависимость температуры кипения от давления.
- •2. Критическое состояние вещества.
- •3. Сжижение газов и использование полученной жидкости в технике.
- •4. Понятие об атмосфере планет.
- •Тема: Кристаллическое и аморфное состояния вещества. Плавление и кристаллизация.
- •1. Кристаллическое состояние вещества. Дальний порядок.
- •2. Кристаллические и аморфные тела.
- •3. Типы кристаллических решеток.
- •Тема. Характеристика жидкого состояния вещества. Поверхностное натяжение. Смачивание. Капиллярность. Вязкость.
- •1. Характеристика жидкого состояния вещества.
- •2. Поверхностное натяжение.
- •3. Смачивание. Капиллярные явления.
- •4. Внутреннее трение в жидкости. Вязкость.
- •Тема. Плавление и кристаллизация. Сублимация. Диаграмма состояния вещества. Тепловое расширение тел.
- •1. Явления плавления и кристаллизации с точки зрения мкт.
- •Тема: Основы электронной теории строения атома. Понятие об электромагнитном поле и его частных проявлениях. Закон Кулона. Диэлектрическая проницаемость среды.
- •Тема: Электрическое поле и его напряженность. Принцип суперпозиции полей точечных зарядов. Графическое изображение полей точечных зарядов.
- •Тема: Работа по перемещению заряда, совершаемая силами электрического поля. Потенциал и разность потенциалов. Связь между напряженностью и разностью потенциалов.
- •Тема: Проводники и диэлектрики в электрическом поле. Электроемкость. Конденсаторы и их соединения. Энергия электрического поля.
- •Электроемкость проводника.
- •Конденсаторы и их соединение. Энергия электрического поля.
- •Тема: Физические основы проводимости металлов. Постоянный электрический ток, его характеристики. Условия, необходимые для возникновения тока.
- •Тема: Электродвижущая сила. Закон Ома для участка цепи и для замкнутой цепи. Параллельное и последовательное соединение проводников.
- •Параллельное и последовательное соединение проводников.
- •Тема: Сопротивление как электрическая характеристика резистора. Зависимость сопротивления резистора от температуры. Понятие о сверхпроводимости.
- •Тема: Работа и мощность постоянного тока. Закон Джоуля – Ленца.
- •1 Основные положения электронной теории проводимости металлов. Законы Ома и Джоуля-Ленца с точки зрения электронной теории.
- •2 Термоэлектричество. Контактная разность потенциалов и работа выхода.
- •Тема: Электрический ток в электролитах. Законы Фарадея для электролиза.
- •Тема: Несамостоятельный и самостоятельный разряды. Понятие плазмы. Электрический ток в вакууме.
- •1. Несамостоятельный и самостоятельный разряды.
- •2. Электрический ток в вакууме.
- •Что такое полупроводники и какими свойствами обладают?
- •2. Чистые полупроводники
- •3. Примесные полупроводник.
- •Тема: Магнитное поле и его основные характеристики. Действие магнитного поля на проводник с током. Закон Ампера.
- •Тема занятия: Магнитный поток. Действие магнитного поля на движущийся заряд. Сила Лоренца..
- •1. Магнитный поток. Работа магнитного поля.
- •2. Действие магнитного поля на движущийся заряд. Сила Лоренца. Определение удельного заряда.
- •Магнитные свойства вещества.
- •Тема :Электромагнитная индукция. Опыт Фарадея. Закон электромагнитной индукции. Правило Ленца. Вихревое электрическое поле. Роль магнитных полей в явлениях, происходящих на Солнце.
- •1 .История открытия явления электромагнитной индукции
- •2 .Опыты Фарадея
- •3 .Возбуждение эдс и индукционного тока.
- •4. Закон электромагнитной индукции.
- •5. Правило Ленца.
- •6. Понятие вихревого электрического поля.
- •7. Определение направлений напряженности электрического и магнитного вихревого полей.
- •8. Основные положения электромагнитной теории Максвелла.
- •Самоиндукция. Эдс самоиндукции.
- •Индуктивность соленоида (катушки).
- •Энергия магнитного поля тока.
- •Энергия электромагнитного поля.
- •Общая характеристика Солнца.
- •6 Роль магнитных полей в явлениях, происходящих в верхних слоях Солнца.
- •Тема : Самоиндукция. Эдс самоиндукции. Индуктивность. Энергия магнитного поля.
- •Самоиндукция. Эдс самоиндукции.
- •Индуктивность соленоида (катушки).
- •Энергия магнитного поля тока.
- •Энергия электромагнитного поля.
- •Общая характеристика Солнца.
- •6 Роль магнитных полей в явлениях, происходящих в верхних слоях Солнца.
- •1. Колебательное движение. Гармонические колебания и их характеристики.
- •2. Превращение энергии при колебательном движении.
- •3. Свободные, затухающие и вынужденные колебания.
- •4 Распространение колебаний в упругой среде. Волны, их характеристики.
- •Свободные электрические колебания. Колебательный контур.
- •2. Преобразование энергии в колебательном контуре:
- •3 Частота и период колебаний в контуре
- •4. Автоколебания. Генератор на транзисторе
- •Получение переменного тока – генератор.
- •2. Действующее значение эдс напряжения и силы переменного тока. Мощность переменного тока.
- •1. Электромагнитное поле и электромагнитная волна.
- •2. Изучение электромагнитных волн. Открытый колебательный контур.
- •3. Физические основы радиосвязи. Принцип радиосвязи.
- •4. Принципы радиосвязи.
- •1. Краткая история развития представлений о природе света.
- •2. Принцип Гюйгенса. Понятие фронта волн и светового луча.
- •3. Скорость распространения света в вакууме и различных средах. Понятие оптической плотности среды.
- •4. Световой поток и освещенность.
- •5. Законы освещенности.
- •6. Сравнение силы света двух источников. Фотометр. Люксметр.
- •7. Отражение света.
- •8. Преломление света.
- •Тема: Интерференция и дифракция света. Проявление их в природе и применение в технике. Понятие о поляризации.
- •Интерференция света.(т. Юнг 1801г; о ж. Френель 1815.)
- •Интерференция света в тонких пленках. Кольца Ньютона.
- •Интерференция света в природе, применение ее в технике.
- •Дифракция света. Дифракционная решетка.
- •Поляризация света.
- •Понятие о голографии.
- •Тема: Дисперсия света. Виды спектров. Цвета тел. Спектральный анализ. Фраунгоферовы линии в спектрах Солнца и звезд
- •1 Дисперсия света.
- •Поглощение света веществом. Цвета прозрачных и непрозрачных тел.
- •3 Излучение и спектры
- •Спектральный анализ.
- •4 Спектры Солнца и звезд.
- •Тема: Электромагнитное излучение в различных диапазонах длин волн: радиоволны, инфракрасное, видимое, ультрафиолетовое и рентгеновское излучения. Шкала электромагнитных волн
- •1. Тепловое излучение. Закон Кирхгофа для теплового равновесия.
- •2. Энергетическая светимость черного тела. Закон Стефана-Больцмана.
- •3. «Ультрафиолетовая катастрофа». Закон Вина.
- •4. Квантовая природа света. Квантовая гипотеза Планка. Энергия кванта.
- •5. Понятие внутреннего и внешнего фотоэффекта.
- •6. Опыты Столетова.
- •7. Законы внешнего фотоэффекта.
- •8. Уравнение Эйнштейна для фотоэффекта.
- •9. Внутренний фотоэффект.
- •Тема: Квантовые свойства света. Понятие о корпускулярно волновой природе света.
- •1 Опыты Резерфорда. Планетарная модель атома.
- •2 Сведения об атоме.
- •Постулаты Бора.
- •1 Радиоактивность.
- •Правило смещения.
- •Закон радиоактивного распада
- •Приборы, регистрирующие заряженные частицы.
- •Биологическое действие радиоактивных излучений.
- •Тема: Состав атомных ядер. Открытие позитрона и нейтрона. Ядерные силы. Дефект массы. Энергия связи атомных ядер.
- •Тема: Общие сведения об элементарных частицах. Античастицы. Взаимные превращения вещества и поля.
- •I. Понятие об элементарных частицах
- •Частицы и античастицы, аннигиляция взаимное превращение вещества и поля.
- •Тема: Термоядерный синтез и условия его осуществления. Баланс энергии при термоядерных реакциях. Проблема термоядерной энергетики. Ядра звезд как естественный термоядерный реактор.
Тема. Идеальный газ. Давление газа. Понятие вакуума. Основное уравнение идеального газа. Абсолютная температура.
1. Идеальный газ. Параметры состояния идеального газа.
В молекулярной физике и термодинамике рассматриваются системы, состоящие из большого числа частиц, т.е. макроскопические системы. Для одной частицы в отдельности нельзя указать ее координату и направление движения, определить температуру и давление. Измеримы только параметры состояния совокупности молекул, т.е. макроскопические характеристики.
При изучении свойств реальных газов пользуются упрощенной моделью – идеальным газом.
Идеальным газом называют такой газ, для которого можно пренебречь размерами молекул, силами молекулярного взаимодействия; соударения молекул в таком газе происходят по закону соударения упругих шаров. В энергетическом отношении молекулы идеального газа обладают кинетической энергией и почти не обладают потенциальной.
Реальные газы ведут себя подобно идеальному газу при достаточно больших разряжениях.
Состояние некоторой массы газообразного вещества характеризуют зависимость друг от друга физическими величинами, называемыми параметрами состояния. К ним относятся объем V, давление р и температура Т.
Единица объема в СИ – 1 м3 [V]= 1 м3.
2. Давление газа. Манометры.
Как возникает давление газа?
Молекулы газа, ударяясь о поверхность тела, например о стенку сосуда, или преграду, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку или преграду сила, действующая со стороны всех молекул на единицу площади, определяет давление газа.
Давление газа – физическая величина, равная отношению силы F, действующей на элемент поверхности нормально к ней, к площади S этого элемента.
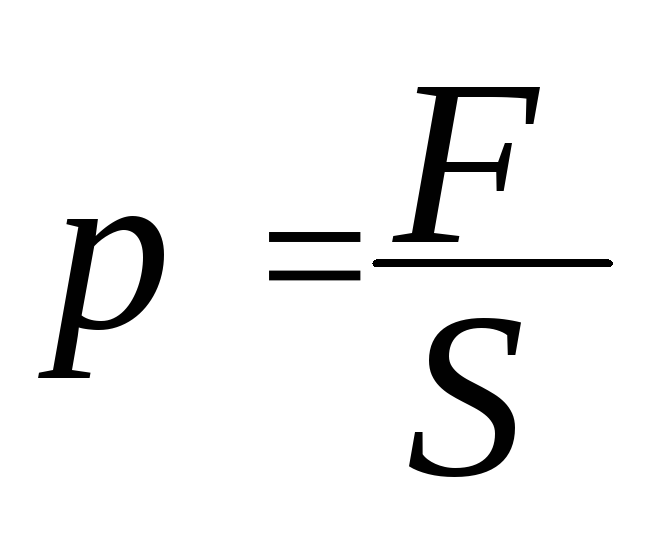 Единица
давления в СИ – паскаль. 1 Н/м2
= 1 Па.
Единица
давления в СИ – паскаль. 1 Н/м2
= 1 Па.
Внесистемные единицы: техническая атмосфера 1ат = 9,81*104 Па;
Физическая атмосфера 1атм = 1,013*105 Па;
1 мм.рт.ст.=133Па; 1атм=760 мм.рт.ст.=1013Па
Приборы, измеряющие давление, называют манометрами.
Познакомьтесь с устройством, принципом действия манометра.
3. Понятие о вакууме. Межзвездный газ.
Состояние газа, при котором средняя длина свободного пробега молекул сравнима с размерами сосуда, в котором заключен газ, называют вакуумом.
«Пустота» межзвездного пространства относительна. Это пространство наполнено не только полями тяготения, электромагнитными, но и мельчайшими пылинками, молекулами и атомами газа – межзвездным газом. Этот газ был обнаружен по линиям поглощения в спектрах звезд. Радиоастрономия позволяет обнаруживать этот невидимый газ по радиоволнам, которые он излучает.
4. Основное уравнение МКТ газов.
Давление газа в сосуде обусловлено ударами молекул о его стенки.
![]() -
основное уравнение МКТ газа
-
основное уравнение МКТ газа
Основное уравнение МКТ газа определяет макроскопическую величину – давление газа через концентрацию n молекул, массу m0 отдельных молекул и среднюю квадратичную скорость υкв их движения.
Если через
![]() обозначить среднюю кинетическую энергию
поступательного движения некой «средней»
молекулы, то уравнение можно записать
в виде:
обозначить среднюю кинетическую энергию
поступательного движения некой «средней»
молекулы, то уравнение можно записать
в виде:
![]() - уравнение Клаузиуса.
- уравнение Клаузиуса.
Давление газа равно 2/3 от средней кинетической энергии поступательного движения всех молекул, которые находятся в единичном объеме газа.
5. Температура и ее измерение.
Величины, характеризующие состояние макроскопических тел без учета молекулярного строения тел называются макроскопическими параметрами (V, р, Т).
Температура характеризует степень нагретости тел. Измеряется термометром. Температура характеризует внутреннее состояние тела.
Тепловым равновесием называют такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными, т.е. в системе не изменяются ни объем, ни давление, ни температура.
Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и туже температуру.
Школа Цельсия: 0 0С – температура таяния льда.
100 0С – температура кипения воды.
В международной системе единиц принята термодинамическая шкала температур.
За нулевую температуру на этой шкале принята температура, при которой прекращается поступательное (тепловое) движение молекул. Эту температуру называют абсолютным нулем.
За вторую опорную точку на термодинамической шкале принята температура, при которой вода находится одновременно в трех состояниях. Температура «тройной» точки по шкале Цельсия 0,01 0С, по термодинамической шкале приняли равной 276,16К(Кельвин).
Температуру, отчитываемую по термодинамической шкале называют термодинамической температурой или абсолютной.
10С=10К Т=t+273,15К, t=Т-273,150С
6. Молекулярно-кинетический смысл температуры. Температура – мера средней кинетической энергии хаотического движения молекул.
Поскольку температура характеризует внутреннее состояние тел, а тела состоят из молекул, то естественно предположить, что температура каким-то образом связана с движением молекул. В пользу такого предположения говорит и ряд опытов.
При постоянном объеме и температуре давление газа пропорционально концентрации молекул р~n.
При нагревании
газа, при постоянном объеме и неизменной
концентрации молекул его давление
растет пропорционально температуре
р~Т. Следовательно, р~nТ
или
![]() ,
где k
– коэффициент пропорциональности.
k=1,38*10-23Дж/К
– постоянная Больцмана.
,
где k
– коэффициент пропорциональности.
k=1,38*10-23Дж/К
– постоянная Больцмана.
Основное уравнение
МКТ газа
![]() ,
имеем
,
имеем
![]() ,
отсюда
,
отсюда
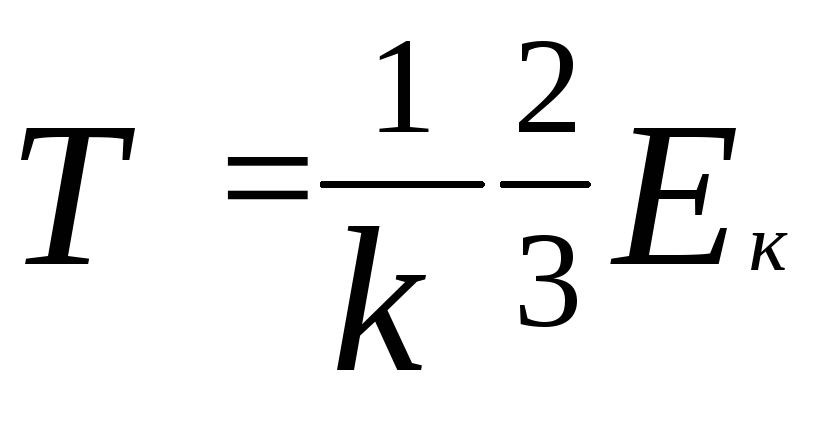
Температура термодинамическая пропорциональная средней кинетической энергии хаотического движения молекул.
Физический смысл
коэффициента
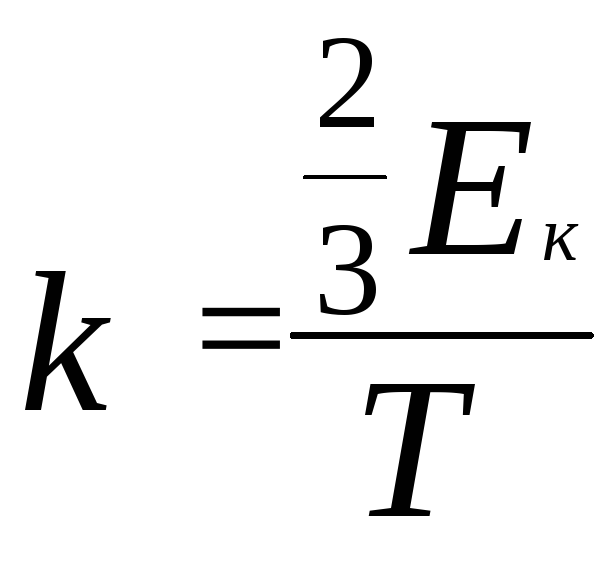 ,
числитель – энергетическая температура,
знаменатель – соответствующая ей
температура в кельвинах. k
– Постоянная Больцмана равна отношению
температуры, выраженной в единицах
энергии (Джоулях) к той же температуре,
выраженной в кельвинах.
,
числитель – энергетическая температура,
знаменатель – соответствующая ей
температура в кельвинах. k
– Постоянная Больцмана равна отношению
температуры, выраженной в единицах
энергии (Джоулях) к той же температуре,
выраженной в кельвинах.
Средняя квадратичная скорость молекул
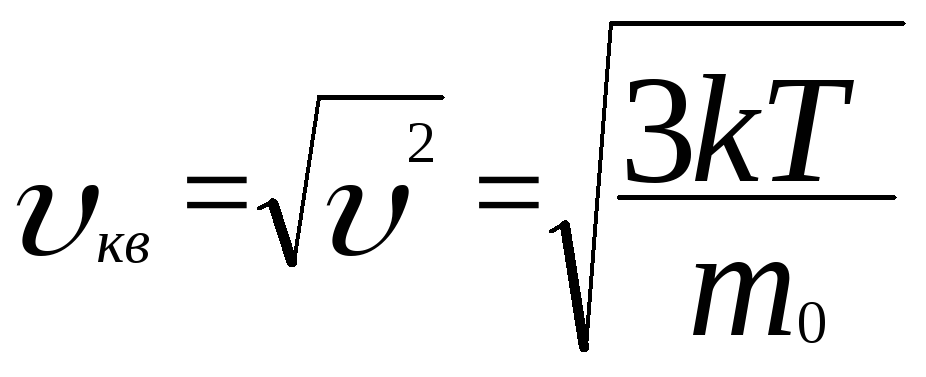
Вопросы для самопроверки:
-
Какой газ называется идеальным газом?
-
Чем объясняется давление газа? Что называется давлением?
-
Сформулировать и записать основное уравнение идеального газа?
-
Какую температуру называют термодинамической?
-
Объяснить молекулярно-кинетический смысл температуры.
-
Почему температура – мера средней кинетической энергии хаотического движения молекул?
Тема: Уравнение Клапейрона - Менделеева. Изопроцессы и их графики. Термодинамическая шкала температур. Абсолютный нуль.
