
РГР 1
.docxМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Брянская государственная инженерно-технологическая академия»
Кафедра Химии
Расчетно-графическая работа №1 по дисциплине Б2. В. Химия
Направление подготовки бакалавров: 250400 – «Технология лесозаготовительных и деревоперерабатывающих производств»
Профиль подготовки: 250403 - «Технология деревообработки»
Квалификация (степень) выпускника: «бакалавр»
Форма обучения: очная
Составитель: к.х.н., доцент кафедры химии С.В. Лукашов
Брянск 2011
Введение
Химия является не только общетехнической, но и общеобразовательной наукой. Поэтому бакалавр любого направления подготовки должен обладать достаточными знаниями в области химии.
Изучение курса химии должно способствовать развитию у студентов логического химического мышления и диалектико-материалистического мировоззрения. В результате изучения курса студенты должны получить современное научное представление о материи и формах ее движения, о веществе как одном из видов движущейся материи, о механизме превращения химических соединений, понимать значение химии в промышленности и сельском хозяйстве. Знание курса химии необходимо для успешного изучения последующих общенаучных и специальных дисциплин. Студенты должны прочно усвоить основные законы и теории химии и овладеть техникой химических расчетов; выработать навыки самостоятельного выполнения химических экспериментов и обобщения наблюдаемых фактов.
Один из основных видов учебных занятий студентов – самостоятельная работа над учебным материалом. По курсу химии она слагается из следующих элементов: изучение материала по учебникам и учебным пособиям; решение задач и выполнение контрольных заданий; индивидуальные консультации.
Предлагаемая расчетно-графическая работа содержит перечень контрольных вопросов, которые должны способствовать эффективному закреплению теоретических знаний полученных студентами по курсу общей химии в процессе самостоятельной работы.
Расчетно-графическая работа выполняется в отдельной тетради. На обложке указывается вид работы, факультет, номер группы, фамилия, имя и отчество студента (полностью), номер варианта.
Номер варианта и номера задач из каждой темы соответствуют номеру, под которым записана фамилия студента в журнале учета посещаемости.
При оформлении работы указывается номер задачи в соответствии с перечнем контрольных вопросов и приводится полный текст условия. Решение следует представлять со всеми необходимыми вычислениями, формулами, уравнениями и пояснениями.
Работа сдается для регистрации в методический кабинет (№409).
Рекомендуемая литература
-
Глинка Н.Л. Общая химия.: учебное пособие для вузов / Под ред. А.И. Ермакова. - М.: Интеграл-Пресс, 2002 – 728 с.
-
Глинка Н.Л. Задачи и упражнения по общей химии.: учебное пособие для вузов - М.: Интеграл-Пресс, 2002 – 240 с.
-
Романцева Л.М. и др. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец-ей вузов /Л.М. Романцева, З.Л. Лещинская, В.А. Суханова. -2-е изд., перераб. и доп. - М.: Высш. шк., 1991
Перечень контрольных вопросов на тему: «Основные классы неорганических соединений»
-
Выведите формулы кислот следующих ангидридов: (СН3СО)2О; SO3; N2O5; Р2О5; N2O3; Р2О3; SO2; MnO3; Mn2O7; As2O5; As2O3; Cl2O3; Cl2O7. Назовите эти кислоты.
-
Выведите формулы ангидридов, зная формулы следующих кислот: H2MoO4; H2Cr2O7; HNO3; HBO2; HMnO4.
-
Составьте формулы средних и кислых бариевых солей следующих кислот: H2SO4; H2S; H3PO4; H2SO3; H2C2O4; H2Cr2O7. Назовите эти соли.
-
Изобразите графические формулы следующих солей: MgSO3; Ca(HCO3)2; Na2HPO4; (CuOH)2SO4; (CuOH)2CO3; KAl(SO4)2; KFe[Fe(CN)6]. Назовите эти соли.
-
Определите класс и назовите соли: Al(OH)Cl2; (CuOH)2CO3; Bi(OH)2NO3; ZnOHCl; Ca3(PO4)2; CaHPO4; Ca(H2PO4)2.
-
Назовите следующие соли железа и напишите их графические формулы: Fe2(SO4)3; FeOHCl; [Fe(OH)]2SO4; FeHPO4’ FeOHSO4.
-
Составьте формулы следующих солей: дигидрофосфат кальция, гидрокарбонат кальция, сульфат гидроксоалюминия, сульфит бария, сульфид бария, гидросульфид бария.
-
Составьте формулы всех кальциевых солей фосфористой кислоты и назовите их.
-
Составьте формулы и назовите все соли, которые могут быть образованы при взаимодействии гидроксида железа (III) с ортофосфорной кислотой.
-
Составьте графические формулы следующих солей: Al2S3; AlOHCl2; Al(OH)2Cl; Al2(SO4)3; AlOHSO4; KAl (SO4)2.
-
Исходя из формул солей, выведите формулы соответствующих им кислот: K2H2Sb2O7; Na2S2O7; CaWO4; Na2MoO4; Ca(VO3)2.
-
Назовите следующие соли: Na2S; KClO3; CuS; FePO4; MgOHCl; Al4(P2O7)3; KH3P2O7; (MgOH)2CO3.
-
Укажите заряд кислотных остатков, входящих в состав следующих солей: Al2S3; KMnO4; AlPO4; Fe (NO3)3; Ca(H2PO4)2; K2Cr2O7.
-
Какие оксиды можно получить, разлагая при нагревании следующие вещества: Fe(OH)3, Cr(OH)3, Pb(NO)3, H2SiO3, H2SO4, H3PO4, Ca(HCO3)2. Напишите уравнения реакций.
-
Напишите уравнения реакций образования всех возможных кислых солей:
а) KOH + H2SO3→ б) Ca(OH)2 + H3PO4→
в) KOH + H3PO4 → г) NaOH + H2S →
д) KOH + CO2→ е) Ba(OH)2 + H2SO4 →
-
Напишите уравнения реакций образования всех возможных основных солей:
а) Аl(OH)3 + HNO3 → б) Mg(OH)2 + HCl →
в) Cu(OH)2 +HNO3 → г) Bi(OH)3 + HNO3 →
д) Fe(OH)3+ H2SO4 → е) Al (OH)3 + H2SO4 →
-
Напишите реакции образования всех солей, образовавшихся при взаимодействии гидроксида железа (III) c ортофосфорной кислотой. Назовите эти соли.
-
Напишите реакции образования всех солей, образовавшихся при взаимодействии гидроксида железа (II) c ортофосфорной кислотой. Назовите эти соли.
-
На примере сульфата дигидроксожелеза (III) покажите химизм последовательного перехода основной соли в кислую (гидросульфат железа III).
-
На примере сульфата гидроксожелеза (II) покажите химизм последовательного перехода основной соли в кислую (гидросульфат железа II).
-
На примере дигидроортофосфата железа (III) покажите химизм последовательного перехода кислой соли в основную (ортофосфат дигидроксожелеза III).
-
На примере гидроортофосфата железа (II) покажите химизм последовательного перехода кислой соли в основную (ортофосфат гидроксожелеза II).
-
Переведите в средние следующие соли: гидрокарбонат натрия, хлорид гидроксоцинка, нитрат дигидроксовисмута, гидрокарбонат кальция, гидросульфит магния, гидросульфид бария, гидросульфат калия.
-
Напишите уравнения реакций для следующих превращений: Zn →ZnSO4→Zn(OH)2→Na2ZnO2→ZnCl2→ZnCO3→ZnO.
-
Напишите уравнения реакций для следующих превращений: Al→AlPO4→[Al(OH)2]3PO4→Al(OH)3→Na[Al(OH)4]→[Al(OH)]3(PO4)2→ →[Al(OH)2]3PO4→Al(H2PO4)3→Al2(HPO4)3. Назовите все указанные соли.
-
Исходя из серы, калия, воды и воздуха синтезируйте максимальное количество солей.
-
Каким одним реактивом можно распознать хлориды магния, аммония и алюминия, находящиеся в разных пробирках?
-
Осуществить превращения: NaCl→Na→NaOH→Na2CO3 →NaHCO3 →Na2CO3 →CaCO3 → Ca(HCO3)2
-
Осуществить превращения: N2→ NH3→NH4NO3→NH4OH→[Ag(NH3)2]Cl→AgCl→Ag
-
Имеются отдельные пробирки с растворами хлоридов алюминия, магния, железа(II) и железа (III). По каким признакам и химическими превращениями можно установить содержание каждой пробирки? Приведите уравнения химических реакций.
Перечень контрольных вопросов на тему «Основные законы химии»
-
В 2,48г оксида одновалентного металла содержится 1,84г металла. Вычислите молярные массы эквивалента металла и его оксида. Чему равна мольная и атомная масса этого металла.
-
3,04г некоторого металла вытесняют 0,252г водорода, 26,965г серебра и 15,885г меди из соединений этих металлов. Вычислите эквивалентные массы указанных металлов.
-
Оксид металла содержит 28,57% кислорода, а его фторид 48,72% фтора. Вычислите молярные массы эквивалента металла и фтора.
-
Напишите уравнение реакций гидроксида железа (III) с соляной кислотой при которой образуются: а) хлорид дигидроксожелеза(III), б) хлорид гидроксожелеза(III), в) хлорид железа (III). Вычислите эквивалент и молярную массу эквивалента гидроксида железа в этих реакциях.
-
Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия, б)нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и молярные массы эквивалентов.
-
Вещество содержит 38% серы и мышяк. Молярная масса эквивалента серы 16,0 г/моль. Вычислите молярную массу эквивалента и валентность мышьяка, составьте формулу данного сульфида.
-
Избытком соляной кислоты подействовали на растворы: а) гидрокарбоната кальция, б) хлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с НCI, определите их эквиваленты и молярные массы эквивалентов.
-
При окислении 16,74г двухвалентного металла образовалось 21,54г оксида. Вычислите молярные массы эквивалентов металла и его оксида.
-
При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу металла.
-
На нейтрализацию 0,943г фосфористой кислоты израсходовано 1,291 г КОН. Вычислите основность кислоты и молярную массу эквивалента
-
Соединение металла с галогеном содержит 64,5% галогена, оксид того же металла содержит 15,4% кислорода. Определите галоген.
-
Вычислите молярную массу эквивалента оксида углерода (IV) в реакциях образования с раствором КОН: а)КНСО3 , б) К2 СО3 .
-
На нейтрализацию 2,3 г основания израсходовано 2,14 г НСI. Вычислить молярную массу эквивалента основания.
-
В каком количестве NаОН содержится столько же эквивалентов, сколько в 140г КОН?
-
В каком количестве Ва(ОН)2•8Н2О содержится столько же эквивалентов, сколько в 156г АI(OH)3 ?
-
0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль
-
Серная и ортофосфорная кислоты имеют одинаковую молярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацтю одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
-
1,6г кальция и 2,61 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить молярную массу эквивалента цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль?
-
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
-
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,4 г соли. Вычислить молярную массу эквивалента вещества и образовавшейся соли.
-
При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2 . Найти молекулярную формулу газа.
-
Найти молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2%.
-
При пропускании над катализатором смеси, состоящей из 10 молей оксида серы (IV) и 15 молей кислорода, образовалось 8 молей оксида серы (VI). Сколько молей диоксида серы и кислорода не вступило в реакцию?
-
При пропускании водяного пара над раскаленным углем получается водяной газ, состоящий из равных объемов СО и водорода. Какой объем водяного газа (н.у.) может быть получен из 3 кг угля?
-
Через раствор, содержащий 7,4 г гидроксида кальция, пропустили 3,36 л диоксида углерода (н.у.). Найти массу вещества, образовавшегося в результате реакции.
-
Рассчитать массу кристаллогидрата Cu(NO3)2•3Н2О, полученного растворением 10г меди в азотной кислоте и последующим выпариванием раствора.
-
В одном из двух закрытых баллонов одинаковыми объемами находится кислород, в другом – азот. Массы обоих газов одинаковы. Температура обоих газов 27 0С. В каком баллоне давление больше и во сколько раз? До какой температуры следует нагреть содержимое одного баллона, чтобы давление внутри него достигло давления в другом баллоне?
-
В закрытом баллоне находится 160г кислорода под давлением 121,6 кПа при 12 С. Вычислить массу диоксида углерода в таком же объеме, если он находится под давлением 202,6 кПа и при 37 0С.
-
Сколько литров кислорода при 21 0С и 104,5 кПа выделится при разложении 490 г КСlО3 ?
-
1 г металла соединяется с массой хлора, занимающей 336 мл при 37 0С и 98 кПа. Вычислить молярную массу эквивалента металла.
Перечень контрольных вопросов на тему: «Термохимия»
-
Вычислить теплоту перехода графита в алмаз, если известно, что теплота образования СО2 из графита равна – 393,5 кДж/моль, а из алмаза = -39,54 кДж/моль.
-
Исходя из тепловых эффектов реакций окисления As2O3 + O2 = As2O5;
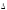 H0
= - 271 кДж; 3As2O3
+ 2O3 =
3As2O5;
H0
= - 271 кДж; 3As2O3
+ 2O3 =
3As2O5;
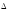 H0
= -1096 кДж, вычислить
теплоту образования озона из молекулярного
кислорода.
H0
= -1096 кДж, вычислить
теплоту образования озона из молекулярного
кислорода. -
Определить энтальпию образования
 Н0
(BiCI3
г), если
энтальпия образования
Н0
(BiCI3
г), если
энтальпия образования
 Н0
(BiCI3
тв) равна
– 270,7 кДж/моль, а тепловой эффект
возгонки BiCI3
тв
составляет 113,39 кДж/моль.
Н0
(BiCI3
тв) равна
– 270,7 кДж/моль, а тепловой эффект
возгонки BiCI3
тв
составляет 113,39 кДж/моль. -
При сгорании 9,3г фосфора выделяется 229,5 кДж теплоты. Рассчитать теплоту образования оксида фосфора (V).
-
Найти теплоту сгорания алмаза, если стандартная теплота сгорания графита равна –393,51 кДж/моль, а теплота фазового перехода Сгр → Салмаз равна 1,88 кДж/моль.
-
Какое количество теплоты выделится при превращении 1кг красного фосфора в черный, если теплоты образования красного и черного фосфора равны –18,41 и – 43,2 кДж/моль соответственно.
-
Сожжены с образованием водяного пара (газ) равные объемы водорода и ацетилена, взятые при одинаковых условиях. В каком случае выделится больше теплоты и во сколько раз?
-
Найти массу метана, при полном сгорании которого (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100г воды от 20 до 30 0С. Мольную теплоемкость воды принять равной 75,3 Дж/мольК.
-
Вычислить значение
 Н0
для протекающих в организме реакций
превращения глюкозы: а) С6Н12О6
=2С2Н5ОН
+ 2СО2;
б) С6Н12О6
+ 6О2
= 6СО2
+ 6Н2О.
Какая из этих реакций поставляет
организму больше энергии?
Н0
для протекающих в организме реакций
превращения глюкозы: а) С6Н12О6
=2С2Н5ОН
+ 2СО2;
б) С6Н12О6
+ 6О2
= 6СО2
+ 6Н2О.
Какая из этих реакций поставляет
организму больше энергии? -
По табличным данным вычислить
 G0
ниже приведенных реакций и определить
принципиальную возможность их
осуществления в стандартных условиях:
а) 2NH3
+2,5O2
= 2NO
+ 3H2O;
б) 2NO
+ O2
= 2NO2;
G0
ниже приведенных реакций и определить
принципиальную возможность их
осуществления в стандартных условиях:
а) 2NH3
+2,5O2
= 2NO
+ 3H2O;
б) 2NO
+ O2
= 2NO2;
-
Для каких оксидов (в скобках приведены
 G0
их образования в кДж/моль) принципиально
осуществима реакция восстановления
водородом в стандартных условиях: а)
Rb2O
(-291) ; б) MnO2
(-363); в) CuO
(-129); г) PbO2
(-189)?
G0
их образования в кДж/моль) принципиально
осуществима реакция восстановления
водородом в стандартных условиях: а)
Rb2O
(-291) ; б) MnO2
(-363); в) CuO
(-129); г) PbO2
(-189)? -
Можно ли получить при стандартных условиях пероксид водорода по реакции? 2Н2+О2 =2Н2О2, если ΔН0 (Н2О2) = -87,9 кДж/моль, S0(H2O2) =109,6 Дж/мольК.
-
Можно ли при стандартной температуре получить аммиак по реакции: NH4CI + NaOH = NaCI + H2O +NH3?
-
Эндотермическая реакция протекает по уравнению СН4 + СО2 = 2СО + 2Н2; ΔН0 = +243,37 кДж. При какой температуре начнется эта реакция?
-
Вычислить стандартный потенциал Гиббса для реакции каталитического окисления аммиака (продукты NO и H2O). Возможна ли эта реакция при стандартных условиях?
-
На основании расчета потенциала Гиббса укажите в каком направлении будут протекать при стандартных условиях приведенные ниже реакции окисления: а) оксида серы (IV) , оксида углерода (II) и водорода ?
-
Оцените возможность осуществления реакции СО+3Н2 = СН4+Н2О при стандартных условиях.
-
Определите, при какой температуре начнется реакция восстановления Fe3O4 по реакции: Fe3O4 + CO = 3FeO +CO2; ΔH0 = +34,55 кДж.
-
При какой температуре начнется реакция диссоциации пентахлорида фосфора: PCI5 = PCI3 + CI2 ; ΔH0 =+ 92,6 кДж?
-
Вычислите стандартный потенциал Гиббса реакции горения этилена исходя из табличных значений стандартных теплот образования (ΔH0) и абсолютных стандартных энтропий (S0) соответствующих веществ.
-
Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: СаО, РbO, FeO, Cr2O3?
-
Покажите, что в стандартных условиях реакция: Cu + ZnO = CuO + Zn невозможна.
-
Какая из ниже перечисленных реакций возможна при стандартных условиях: а) N2 + 1/2O2 = N2O; б) 4HCI + O2 = 2CI2 + 2H2O; в) Fe2O3 + 3CO = 2Fe + 3CO2?
-
Вычислить G0 и определить принципиальную возможность их осуществления в стандартных условиях: а) SO2 +H2S = 3S +2H2O; б) 2HCI + 1/2O2 = CI2 + H2O.
-
В каком направлении будет протекать реакция получения аммиака из хлорида аммония: NH4CI + NaOH = NaCI + H2O + NH3?
-
Вычислить G0 образования СН4 ,С2Н4 и NH3 исходя из значений Н0 и изменения энтропии химической реакции S0. Полученные данные сравните с данными, приведенными в таблицах.
-
Определите принципиальную возможность протекания нижеследующих реакций при стандартных условиях: а) 2NH3 + 2,5O2 = 2NO2 + 3H2O; б) N2O + 1/2O2 = 2NO.
-
Вычислить G0 для приведенных ниже реакций и определить принципиальную возможность их осуществления в стандартных условиях: а)SO2+2H2S=3S+2H2O; б) 2HCI + 1/2O2 = CI2 + H2O.
-
Вычислить G0 для приведенной ниже реакции и определить принципиальную возможность ее осуществления в стандартных условиях: Sе + H2 = H2Se.
-
Вычислить значения G0 следующих реакций восстановления оксида железа (II): а) FeO + ½ C(графит) = Fe + ½ CO2; б) FeO + C (графит) = Fe + CO.
Перечень контрольных вопросов на тему: «Химическая кинетика»
-
Реакция протекает по схеме 2А+3В=С. Концентрация А уменьшилась на 0,1 моль/л. Каково при этом изменения концентраций веществ В и С?
-
Начальные концентрации веществ, участвующих в реакции СО+Н2О=СО2 +Н2 были равны (моль/л, слева на право): 0,3; 0,4; 0,4; 0,05. Каковы концентрации всех веществ в момент, когда прореагировала ½ часть от начальной концентрации СО?
-
Начальные концентрации веществ участвующих в реакции N2+3H2 =2NH3, равны (моль/л, слева на право): 0,2; 0,3; 0. Каковы концентрации азота и водорода в момент, когда концентрация аммиака станет равной 0,1 моль/л.
-
Во сколько раз изменится скорость реакции 2А +В→АВ, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 3 раза?
-
Через некоторое время после начала реакции 3А+В→2С+D составляли (моль/л, слева на право): 0,03; 0,01; 0,008. Каковы исходные концентрации веществ А и В?
-
В системе СО + СI2 = CОCI2 концентрацию СО увеличивали от 0,03 до 0,12 моль/л, а хлора от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
-
Начальные концентрации веществ А и В в реакции А+2В→С были 0,03 и 0,05 моль/л соответственно. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
-
Как изменится скорость реакции 2NO+O2→2NO2, если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза?
-
Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А +В2 = 2А В , чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась?
-
Во сколько раз следует увеличить концентрацию оксида углерода (II) в системе 2СО=СО2+С, чтобы скорость реакции увеличилась в 100 раз? Как изменится скорость реакции при увеличении давлении в 5 раз?
-
Начальные концентрации веществ в реакции СО + Н2О→СО2+Н2, были равны (моль/л, слева на право): 0,05; 0,06; 0,4 и 0,2. Вычислить концентрации всех участвующих в реакции веществ после того, как прореагировала 60% воды.
-
При повышении температуры на 60 0С скорость реакции увеличилась в 4•102 раз. Вычислить
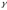 .
. -
Сколько времени потребуется для завершения реакции при 18 0С, если при 90 0С она завершается за 20 секунд, а
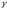 =3,2?
=3,2? -
При 10 0С реакция заканчивается за 95 с, а при 20 0С за 60 с. Вычислить энергию активации.
-
Во сколько раз возрастет скорость реакции при повышении температуры с 30 до 50 0С, если энергия активации равна 125,5 кДж/моль?
-
Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергию активации ее уменьшить на 4 кДж/моль?
-
Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280?
-
Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличится в 2 раза?
-
Энергия активации некоторой реакции равна 10 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 0С?
-
При 150 0С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент за 2,5 рассчитать, через какое время закончится эта реакция, если проводить ее: а) при 200 0С, б) при 80 0С?
-
При какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа? Температурный коэффициент реакции 3,2.
-
Реакция CO+CI2= COCI2 протекает в объеме 10литров. Состав равновесной смеси: 14г СО; 35,6г CI2; и 49,5г СOCI2. Вычислить константу равновесия реакции.
-
После смешения газов А и В в системе А+В = С+D, устанавливается равновесие при следующих концентрациях (моль/л): [B]=0,05; [C]=0,02. Константа равновесия реакции равна 4•10-4. Найти исходные концентрации А и В.
-
Константа равновесия реакции FeO+CO = Fe+CO2 при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): [CO]= 0,05 и [CO2] =0,01.
-
Найти константу равновесия реакции N2O4 = 2NO2, если начальная концентрация N2O4 составляет 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4.
-
Константа равновесия реакции А+В=С+D равна единице. Начальная концентрация [А] =0,02моль/л. Сколько процентов А подвергается превращению, если начальные концентрации [В] равны 0,02; 0,1 и 0,2 моль/л?
-
Для реакции Н2+Вr2=2HBr при некоторой температуре К=1. Определить состав (% по объему) равновесной смеси, если исходная смесь состояла из 3 молей Н2 и 2 молей брома.
-
В начальный момент реакции синтез аммиака концентрации были (моль/л): N2=1,5; H2=2,5; NH3=0. Какова концентрация азота и водорода при концентрации аммиака 0,15 моль/л?
-
Равновесие в системе H2 + I2 =2HI установилось равновесие при следующих концентрациях (моль/л): [H2]= 0,025; [I2] =0,005; [HI]=0,09. Определить исходные концентрации йода и водорода.
-
При нагревании смеси диоксида углерода и водорода в закрытом сосуде установилось равновесие СО2 + Н2 = СО + Н2О. Константа равновесия при некоторой температуре равна 0,1. Сколько процентов СО2 превратится в СО, если смешать 2 моля СО2 и 1 моль Н2 при той же температуре.
