
- •Термодинамика
- •Ключевые вопросы
- •44**.Выведите значение кпд теплового двигателя через количество теплоты, получаемого рабочим телом от нагревателя, и количество теплоты, отдаваемого рабочим телом холодильнику.
- •58**.Выведите значение количества теплоты, забираемого от холодильника, через кпд и работу машины.
- •Требования к уровню знаний:
- •Критерии оценивания на зачете № 1 «Ключевые вопросы».
- •Структурно-логические схемы
- •Важно запомнить с пониманием
- •III. Обучающий тест
- •Требования к уровню знаний:
- •Критерии оценивания на зачете № 2 «Тест для самопроверки».
- •IV. Задачи для самостоятельного решения
- •Требования к оформлению отчетов по домашним задачам:
- •Критерии оценивания на зачете № 3 «Задачи для самостоятельного решения».
- •Критерии оценивания на зачете № 4 «Контрольная работа».
- •V. Ответы, подсказки, примеры Ответы и подсказки к тесту
- •Ответы и подсказки к задачам
Ответы и подсказки к задачам
1.
20 кДж. 2*. 15 кДж. 3*. 9 кДж. 4**. ≈
113 К, если пренебречь теплоемкостью
сосуда. 5. 22,4 кДж. 6. 897 Дж. 7**.
3,7 кДж, 2,2 кДж, 1,5 кДж. Подсказка.
Для двухатомного газа количество
степеней свободы молекул i
= 5, причем i = 3
приходится на долю поступательного
движения и i = 2 –
на долю вращательного движения. 8**.
83 кДж. 9*. 450 Дж. 10*. Увеличилась в
3,2 раза. 11*. 180 кПа. 12*. 750 Дж.
13**. 100 кПа; 1,5 г. 14**.
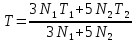 .
Подсказка: необходимо использовать
закон сохранения суммарной кинетической
энергии всех молекул в теплоизолированной
системе. 15. 1а: ΔU12
> 0 (увеличивается), ΔU23
< 0 (уменьшается), ΔU31
= 0 (не изменяется); 1б: ΔU12
> 0; ΔU23 = 0, ΔU31
< 0 . Подсказка. В случае 1а об
изменении внутренней энергии можно
судить непосредственно по изменению
температуры. В случае 1б об изменении
внутренней энергии можно судить по
изменению произведения рV,
которое в соответствии с уравнением
Менделеева-Клапейрона меняется
пропорционально температуре: рV
= vRT, при этом надо
иметь в виду, что переход 2–3 -
изотермический, то есть Т23 -
постоянная величина. 16. ΔU
≈ 499 Дж. 17.ΔU
≈ -25 Дж. 18. ΔU = 600
кДж. 19. ΔU = - 450 кДж.
20**. Г.
.
Подсказка: необходимо использовать
закон сохранения суммарной кинетической
энергии всех молекул в теплоизолированной
системе. 15. 1а: ΔU12
> 0 (увеличивается), ΔU23
< 0 (уменьшается), ΔU31
= 0 (не изменяется); 1б: ΔU12
> 0; ΔU23 = 0, ΔU31
< 0 . Подсказка. В случае 1а об
изменении внутренней энергии можно
судить непосредственно по изменению
температуры. В случае 1б об изменении
внутренней энергии можно судить по
изменению произведения рV,
которое в соответствии с уравнением
Менделеева-Клапейрона меняется
пропорционально температуре: рV
= vRT, при этом надо
иметь в виду, что переход 2–3 -
изотермический, то есть Т23 -
постоянная величина. 16. ΔU
≈ 499 Дж. 17.ΔU
≈ -25 Дж. 18. ΔU = 600
кДж. 19. ΔU = - 450 кДж.
20**. Г. 21. А = 200 Дж; А’= -
200 Дж. 22. А = - 500 Дж; А’= 500 Дж.
23. А = 400 Дж; ΔТ ≈ 24 К; ΔU
= - 600 Дж. Подсказка. Для определения
изменения температуры газа необходимо
воспользоваться уравнением
Менделеева-Клапейрона. 24. А ≈
665 Дж. Подсказка. Разберите пример
1.
21. А = 200 Дж; А’= -
200 Дж. 22. А = - 500 Дж; А’= 500 Дж.
23. А = 400 Дж; ΔТ ≈ 24 К; ΔU
= - 600 Дж. Подсказка. Для определения
изменения температуры газа необходимо
воспользоваться уравнением
Менделеева-Клапейрона. 24. А ≈
665 Дж. Подсказка. Разберите пример
1.
Пример 1. Какую работу совершает 1 моль идеального газа при его изобарном нагревании от 20 оС до 22 оС?
Решение. Поскольку нагревание происходит при постоянном давлении, то имеем право воспользоваться формулой для работы газа в виде: А = р∆V. По условию неизвестны изменение объема ∆V, а также давление газа. Но все три термодинамических параметра газа взаимосвязаны уравнением Менделеева-Клапейрона. Запишем это уравнение дважды – для начального и конечного состояния газа:
pV1 = νRT1 (1)
pV2 = νRT2 (2)
Вычтем из левой и правой частей второго уравнения соответствующие части первого уравнения:
р(V2 – V1) = νR(T2 – T1), или: р∆V = νR ∆T. Но р∆V = А, следовательно, при изобарном процессе работу можно определить по формуле: А = νR ∆T . При заданных условиях, работа газа равна А = 16,6 Дж.
25. А ≈ 33,24 кДж. 26*. Ав/Аа = 14. 27. 12 . 105 Дж; -1,7 . 104 Дж; 0. Подсказка. В случае, изображенном на рисунке 2в, давление меняется прямо пропорционально температуре. Следовательно, это изохорный процесс, то есть объем газа не меняется ∆V = 0, и газ не совершает работу. 28. А12 = 0; А23 = 18 . 105 Дж; А34 = 0; А41 = -6 .105Дж; А = 12 . 105 Дж; на участке 4-1; Т4 ≈ 481 К. 29. 12 . 105 Дж. Подсказка. Процесс не изобарный, следовательно нельзя пользоваться формулой для работы газа в виде А = р∆V . Но можно воспользоваться тем, что работа газа численно равна площади под графиком зависимости р(V), в данном случае - площади трапеции. При расчете площади (работы газа) следите за единицами измерения величин вдоль каждой оси. 30. 600 кДж. Подсказка. График р(V) замкнутый. Следовательно, работа газа равна площади, ограниченной этим графиком, то есть площади треугольника. Знак результирующей работы положительный, так как положительная работа газа (площадь трапеции под переходом 1-2) больше по модулю отрицательной работы газа (площади под переходом 3-1). 31. – 5 . 105 Дж. 32*. 105 Дж; над поршнем и атмосферным воздухом; 5 Дж; увеличилась потенциальная энергия поршня на 5 Дж, увеличилась внутренняя энергия атмосферного воздуха на 105 Дж. Подсказка. Разберите пример 2.
Пример 2.
В
цилиндре сечения S
=250 см2 находится азот, сжатый
невесомым поршнем, на котором лежит
гиря массы М =12,5 кг. При его изобарном
нагревании поршень поднялся на ∆h
= 20 см. Какую работу совершил газ? Какую
работу совершил газ над поршнем?
Атмосферное давление р0 = 105
Па. Трением поршня о стенки сосуда
пренебречь. 
Решение. Полезно графически представить себе состояние системы в начале и в конце процесса (см. рис. 1).
По условию нагревание газа производится изобарно, то есть давление газа постоянно, поэтому можно воспользоваться формулой для работы газа, которая справедлива лишь при изобарном изменении его объема: А = р∆V. Процесс будет изобарным, если нагревание происходит настолько медленно, что поршень поднимается равномерно. Тогда, согласно второму закону Ньютона, сумма сил действующих на поршень, равна нулю. На поршень действуют силы: сила атмосферного давления p0S, вес груза Mg и сила давления газа pS. Следовательно: p0S + Mg = pS. То есть:

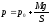
Изменение
объема газа равно: ∆V
= S∆h.
Таким образом, работа газа будет равна:
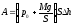 .
Подставив числовые значения, получим:
А = 50025 Дж.
.
Подставив числовые значения, получим:
А = 50025 Дж.
Возникают вопросы: 1) над какими телами газ совершил данную работу; 2) какие энергетические изменения произошли с этими телами в результате работы газа над ними (работа, совершенная над телом – мера изменения его энергии). Безусловно, газ совершает работу над поршнем с грузом. В результате этой работы потенциальная энергия груза увеличивается: ∆W = Mg∆h = 12,5кг.10м/с2.0,2м = 25 Дж. Следовательно, именно в 25 Дж совершается газом работа над поршнем. Но полная работа газа значительно больше! Многие делают серьезную ошибку, отвечая, что газ совершает работу только над поршнем. Поскольку газ совершает работу и против силы атмосферного давления, то именно над атмосферным воздухом и совершается газом остальная (и в данном случае, основная) работа в 50000 Дж. В результате, именно на 50000 Дж увеличивается внутренняя энергия окружающего воздуха: молекулы воздуха, сталкиваясь с движущимся поршнем приобретают дополнительный импульс, следовательно, и дополнительную кинетическую энергию.
33*. В кинетическую энергию баллончика (если он не закреплен) и кинетическую энергию газовой струи. 34*. 0,22 г. 35*. ∆T ≈ 13 К. Подсказка. Обратите внимание на то, что положительная работа совершена над газом внешними телами. 36**. 324 К; ≈ 0,031 м3. 37**. T = const .V2; A = 3PoVo/2. Подсказка. Разберите пример 3.
Пример 3. Идеальный газ нагревается так, что температура изменяется прямо пропорционально значению квадрата его давления. Найдите работу, произведенную газом, при увеличении его объема от V1 до V2.
Решение. Так как расширение газа происходит при переменном давлении, то мы не можем пользоваться формулой для работы газа при изобарном процессе: А = р∆V . Возможно, удастся использовать тот факт, что работа газа численно равна площади под графиком р(V). Но чтобы построить график р(V), необходимо знать уравнение этой зависимости. Запишем два уравнения, отражающие связь параметров газа в данном процессе:
pV = νRT (1) - уравнение Менделеева-Клапейрона;
Т = αр2 (2) – по условию задачи, где α - введенный коэффициент пропорциональности между Т и р2.
Исключим из этих уравнений параметр Т, подставив его значение из уравнения (2) в уравнение (1): pV = νRαр2. Таким образом: р = V/νRα. Построим интересующий нас график (рис. 2).
Фигура
под графиком – трапеция, чья площадь,
а следовательно, и работа газа равна: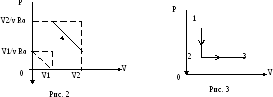

Разумеется, если бы зависимость р(V) оказалась не линейной, то решение было бы более сложным. Во всяком случае, более сложным настолько, насколько Вы не владеете таким математическим действием, как интегрирование.
38**. A = mRα(V22 – V21)/2M. 39**.T = A/R(k - 1). Подсказка. Разберите пример 4.
Пример 4. Состояние моля идеального газа изменялось вначале по изохоре 1-2, а затем по изобаре 2-3 (рис. 3). При этом газом совершена работа А. Известно, что температура в конечном состоянии 3 и в состоянии 1 одинакова и равна Т. Определить отношение давлений в состояниях 1 и 2.
Решение. Переход 1-2 – изохорный. Следовательно, искомое значение отношений давлений равно р1/р2 = Т1/Т2 , или (с учетом условия Т1 = Т):
р1/р2 = Т/Т2 (1)
Очевидно, необходимо попытаться определить Т2 через заданное значение работы газа А. Газ совершил работу при изобарном расширении на переходе 2-3 (на участке 1-2 работу газ не совершает, т.к. V = const): А = р2(V3 – V2). Из уравнения Менделеева-Клапейрона для изобарного процесса справедливо: р∆V = νR∆T. То есть работа газа на участке 2-3 равна: А = νR(Т3 – Т2), или – с учетом условия Т3 = Т:
А= νR (Т - Т2)
Из последнего уравнения выразим Т2: Т2 = vRT – A. Подставив это значение в уравнение (1), получаем: р1/р2 = Т/ (vRT – A) , или с учетом условия v = 1:
р1/р2 = Т/(RT – A)
40**.
v(Т1
– Т2)(Т1
– Т0)R/T1.
Подсказка. Обязательно постройте
график р(V). 41**.
R (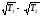 )2.
42.Увеличилась на 7,5 МДж. 43*.9а: Q12
> 0, Q23 > 0, Q31
< 0, Q > 0; 9б: Q12
> 0, Q23 < 0, Q31
> 0, Q < 0; 9в: Q12
> 0, Q23 > 0, Q31
< 0, Q < 0. Подсказка.
Разберите пример 5.
)2.
42.Увеличилась на 7,5 МДж. 43*.9а: Q12
> 0, Q23 > 0, Q31
< 0, Q > 0; 9б: Q12
> 0, Q23 < 0, Q31
> 0, Q < 0; 9в: Q12
> 0, Q23 > 0, Q31
< 0, Q < 0. Подсказка.
Разберите пример 5.
Пример 5. На рисунке 4 изображен циклический процесс, проведенный с газом при неизменной его массе. Опишите характер теплообмена газа при каждом переходе, составляющем цикл. Каков характер теплообмена газа за полный цикл?
Решение.
Определение характера теплообмена газа
предполагает ответ на вопрос, отдает
газ количество теплоты окружающим телам
(Q < 0) или наоборот –
получает (Q > 0).
Согласно первому закону термодинамики
количество теплоты, получаемое газом,
идет на совершение им работы и на
увеличение его внутренней энергии:
Q = ∆A + ∆U (1)
Если правая часть равенства (1) больше нуля, то газ получает тепло, и наоборот: если меньше нуля, то – отдает.
Рассмотрим переход 1-2. Это изобарный процесс, поскольку р12 = const, и идет с увеличением температуры ∆Т12 > 0, следовательно, внутренняя энергия газа увеличивается: ∆U12 > 0. При изобарном процессе объем прямо пропорционален температуре. Значит, на этом участке объем так же увеличивается ∆V12 > 0, следовательно, газ совершает положительную работу над внешними телами: ∆А12 > 0. Таким образом, на участке 1–2 газ получает некоторое количество теплоты Q12 = ∆U12 + ∆А12 > 0.
Рассмотрим участок 2–3. Он описывает изотермический процесс, поскольку Т23 = const (∆Т23 = 0). Следовательно, внутренняя энергия газа не изменяется: ∆U23 = 0. Давление увеличивается, а поскольку при изотермическом процессе давление газа обратно пропорционально его объему, то на этом участке объем газа уменьшается: ∆V23 < 0. Следовательно, А23 < 0. Таким образом, на участке 2–3 газ отдает некоторое количество теплоты Q23 = 0 + А23 < 0.
Аналогично рассуждая, рассмотрим участок
3–1. На этом переходе давление газа
уменьшается прямо пропорционально его
температуре, следовательно, это изохорный
процесс. Значит V31
= const (∆V31
= 0), следовательно, А31 = 0.
Температура газа уменьшается ∆Т31
< 0, следовательно, ∆U31
< 0. Таким образом, на участке 3–1
газ отдает некоторое количество теплоты
Q31 = ∆U31
+ 0 < 0. Итак:
Каков же характер теплообмена газа за весь цикл? То есть, каков знак суммы Q = Q12 + Q23 + Q31? Ответить на этот вопрос можно, применив первый закон термодинамики сразу ко всему циклу: Q = ∆A + ∆U. Поскольку газ в результате замкнутого цикла из состояния 1 опять вернулся к тому же состоянию 1 с теми же термодинамическими параметрами, то и ∆Т = 0, следовательно, ∆U = 0 за весь замкнутый цикл, тогда: Q = A – полной работе газа за весь замкнутый цикл.
Полная работа газа за весь цикл численно равна площади фигуры, ограниченной графиком р(V). Вопрос, каков знак этой площади. Построим график зависимости р(V) - рис. 5. Площадь фигуры по модулю равна площади под графиком р(V) на участке 3-2 минус площади фигуры под графиком р(V) на участке 1-2. При этом отметим, что отрицательная работа газа на участке 3-2, где объем уменьшается, больше по модулю положительной работы на участке 1-2, где объем увеличивается: |A32| > |A12|. Значит, полная работа газа за весь цикл A = A32 + A12 =- |A32| +| A12| < 0. Таким образом, за весь цикл Q = А < 0, то есть газ отдает количество теплоты окружающим телам.
44. а) получил 1 МДж; б) отдал 1 МДж. Подсказка. Обратите внимание, что в условии говорится о значении работы не самого газа, а над газом. 45. 665 кДж; 1335 кДж. 46*.99,7 кДж; 149,6 кДж; 249,3 кДж. 47*. cV/(cV + R); R/(cV + R). Подсказка. При изохорном процессе газ не совершает работы, так как V = const, и поэтому Q = ∆U = сVv∆T. Поэтому изменение внутренней энергии в любом процессе при изменении температуры на ∆T всегда можно выразить как величину сVv∆T. При изобарном процессе Q = ∆U + A = ∆U + p∆V = сVv∆T + vR∆T. 48*. 3 кДж; 4,23 кДж. 49*. В ≈ 2,1 раза; 379 Дж. 50*. ≈ 0,4 м3. 51**. 298 К. 52**. 0,5α(V22 – V12); αсV(V22 – V12)/R. 53**. сV + 0,5R. 54*. ≈ 77 оС. Подсказка. Разберите пример 6.
Пример 6. Моль идеального газа, первоначально находившийся при нормальных условиях, переводят в состояние с вдвое большим объемом и давлением. Процесс перевода слагается из двух участков – изобары и изохоры. Какое количество теплоты подведено к газу? Молярная теплоемкость газа при постоянном объеме сV = 21 Дж/ (моль . К).
Решение.
Изобразим изменение состояния газа
графически в координатах (р,V)
на рисунке 6. Количество теплоты,
подведенное газу, очевидно, состоит из
двух порций: из количества теплоты,
подведенного на участке 1-2 (Q12)
и подведенного на участке 2-3 (Q23):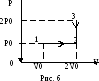
Q = Q12 + Q23
Согласно первому закону термодинамики:
Q12 = ∆U12 + A12
Q23 = ∆U23 + 0, так как процесс 2-3 - изохорный
При любом процессе изменение внутренней энергии газа равно: ∆U = сVv∆T. При изобарном процессе работа газа равна А = р∆V , а V2 = 2V0 , поэтому:
Q12 = сV(T2 – T0) + Р0(V2 – V0) = сV(T2 – T0) +Р0(2V0 – V0) = сV(T2 – T0) +Р0V0 ; Q23 = сV(T3 – T2) .
В уравнениях учтено, что v = 1.
Задача сводится к определению значений Т0, Т2, Т3 и Р0V0. Поскольку в начальном состоянии 1 газ находится при нормальных условиях, то Т0 = 273 К. Температуру газа в конце изобарного процесса 1-2 определим из закона Гей-Люссака: T2/T0 =V2/V0 = 2V0/V0 = 2. Откуда T2 = 2T0. Произведение Р0V0 = RT0 в соответствии с уравнением Менделеева-Клапейрона. Таким образом, Q12 = сVT0 + RT0 = T0(сV + R). Для определения Т3 в состоянии 3 воспользуемся законом Шарля. Так как переход 2-3 – изохорный, то: Т3/Т2 = Р3/Р2. Учитывая, что Т2 = 2Т0, Р2 = Р0 и Р3 = 2Р0, получаем: Т3/2Т0 = 2Р0/Р0. Отсюда: Т3 = 4Т0. Таким образом, мы имеем систему уравнений:
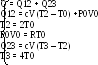
Решая ее относительно Q, получаем: Q = T0(3CV + R) = 20 кДж.
55**. 6 кДж. 56**. В 5/3 раз. Подсказка. Разберите пример 7.
Пример 7. В вакуумном пространстве вертикально стоит цилиндрический сосуд, закрытый сверху подвижным поршнем массы М. Внутри сосуда находится одноатомный газ при давлении р. Внутреннее сечение цилиндра S, а поршень находится на высоте H над его дном. Поршень отпустили. После непродолжительных колебаний он останавливается. На каком расстоянии от начального положения остановится поршень, если теплоемкость газа при постоянном объеме много больше теплоемкости поршня и цилиндра? Вся система теплоизолирована.
Решение.
Изобразим на рисунке начальное и конечное
состояния системы (рис. 7). Мы предположили,
что уровень поршня в конечном состоянии
снизится. Для решения задачи можно
использовать первый закон термодинамики
для газа с учетом того, что процесс
изменения его состояния адиабатный
(система теплоизолирована): 0 = ∆U
+ A, где А –
отрицательная работа газа, совершаемая
над поршнем при переменном давлении.
Но можно использовать закон сохранения
энергии для замкнутой системы:
газ-поршень-земля (атмосферный воздух
исключен по условию). Нулевой уровень
потенциальной энергии поршня возьмем
на уровне его конечного положения. Тогда
в начальном состоянии система имеет
энергию: Mgh + U
+ U`, где U
– внутренняя энергия газа, U`
- внутренняя энергия поршня и цилиндра
в начальном состоянии системы. В конечном
состоянии энергия системы: U1
+ U1`. Поскольку
система замкнута, то энергия системы
сохраняется: Mgh + U
+ U` = U1
+ U1`, или: Mgh
= U1 – U
+ U1`- U`,
или: Mgh = ∆U
+ ∆U` - потенциальная
энергия поршня превращается во внутреннюю
энергию газа и цилиндра с поршнем. Но
по условию задачи теплоемкостью цилиндра
и поршня можно пренебречь в сравнении
с теплоемкостью газа, поэтому можно
считать, что вся потенциальная энергия
поршня превратилась во внутреннюю
энергия газа: Mgh =
∆U. Изменение
внутренней энергии газа при любом
процессе можно выразить: ∆U
= сVv∆T.
По условию v = 1 моль и
газ одноатомный, то есть сV
= 3/2R. Тогда: ∆U
= 3/2R(Т1 –
Т). Задача сводится к поиску значений
Т и Т1. Используем уравнение
Менделеева-Клапейрона: рV
= RT и p1V1
= RT1, где V=
SH, V1
= S(H
- h) и p1
= Mg/S
(последнее – из условий равновесия
поршня в конечном состоянии). Таким
образом, имеем систему уравнений: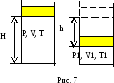
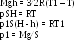
Решая
ее относительно h,
получаем:
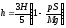 .
.
57**. 2Р0V0/T0. Подсказка. Разберите пример 8.
Пример 8. Состояние одноатомного идеального газа меняется по закону Р = аV, где а – постоянный коэффициент. Определите молярную теплоемкость газа при этом процессе.
Решение. Молярная теплоемкость показывает, какое количество теплоты необходимо, чтобы повысить температуру 1 моля газа на 1 К, и соответственно равна:
Очевидно, необходимо выразить Q через v и ∆Т, чтобы сократились их значения. В соответствии с первым законом термодинамики количество теплоты, переданное газу, идет не только на повышение его внутренней энергии, но и на совершение газом работы:
Q = ∆U + A (1)
Поскольку идеальный газ одноатомный, то изменение его внутренней энергии при повышении температуры на ∆Т равно: ∆U = 3/2Rv∆Т.
Газ
нагревается не изобарно, поэтому мы не
можем использовать соответствующую
формулу для работы газа А = Р∆V.
Попробуем найти работу как площадь под
графиком Р(V).
Построим этот график (рис. 8). Площадь
графиком Р(V) равна
площади трапеции: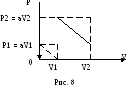
 (2)
(2)
Выразим значение V2 через Т газа. С одной стороны при любом процессе выполняется уравнение Менделеева - Клапейрона: РV = vRT. С другой стороны, по условию Р = аV. Из этих двух последних соотношений, исключив переменную Р, получаем: аV2 = vRT. Используя полученную связь между V и Т, перепишем уравнение (2):
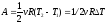 .
Таким образом, уравнение (1) можно
переписать:
.
Таким образом, уравнение (1) можно
переписать:
Q = 3/2Rv∆Т + 1/2vR∆Т = 2vR∆T
Тогда молярная теплоемкость газа будет равна:
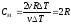 .
.
58**.
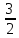 R
ΔТ –
R
ΔТ –
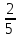 Q.
Подсказка. Разберите пример 9.
Q.
Подсказка. Разберите пример 9.
Пример 9. Моль гелия совершает работу величиной А в замкнутом цикле (рис. 9), состоящем из адиабаты 1-2, изотермы 2-3, изобары 3-1. Найти величину работы, совершаемой в изотермическом процессе, если разность максимальной и минимальной температуры газа в цикле равна ΔТ.
Решение.
Работа газа за весь замкнутый цикл
равна сумме работ на каждом участке: А
= А12 + А23 + А31.
Отсюда искомая работа равна А23
= А - А12 + А23 .
Определим значения А12 и А31.
Переход 1-2 адиабатический, поэтому
для него первый закон термодинамики
имеет вид: 0 = ΔU12
+ А12. Отсюда А12 = -
ΔU12 = - 3/2 vR(T2
– T1). Точка 1
лежит выше изотермы 2-3, поэтому
T1 > T2,
то есть ΔТ = T1
- T2. Тогда
А12 = 3/2 vR ΔТ.
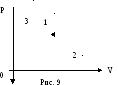
Переход 3-1 изобарный, поэтому А31 = рΔV = vR(T1 – T3). Но T3 = T2, так как точки 3 и 2 лежат на одной изотерме, поэтому А31 = vR(T1 – T2) = vR ΔТ. Таким образом, работа газа в изотермическом процессе равна: А23 = А - 3/2 vR ΔТ - vR ΔТ .
С учетом v = 1 имеем: А23= А - 5/2 R ΔТ. 59**. Q = А + 3/2 R ΔТ. 60.11 %. 61. а) 274 кВт . ч; ≈ 200 кВт . ч. 62*. k Т. 63**. По циклу 1-3-4-1 больше в 23/21 раз. Подсказка. Разберите пример 10.
Пример
10. На рисунке 10 изображен замкнутый
цикл с одноатомным идеальным газом.
Температуры в точках 1 и 3 равны
Т1 и Т3. Определить
КПД цикла, если известно, что точки 2
и 4 лежат на одной изотерме.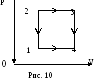
Решение.
По определению КПД тепловой машины
равен:
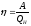 ,
где А – работа, совершенная газом
за цикл; QH
- количество теплоты, переданное газу
(QH
> 0) от нагревателя. По условию Т2
= Т4 = Т. Проанализируем, на
каких переходах газ получает тепло. На
изохорном переходе 1-2 температура
повышается пропорционально давлению,
а работа газом не совершается.
Следовательно, на участке 1-2 газ
получает тепло (Q12
> 0): Q12 = ∆U12
= 3/2Rv(T
– Т1). Здесь учтено, что газ
одноатомный, а следовательно, CV
= 3/2R.
,
где А – работа, совершенная газом
за цикл; QH
- количество теплоты, переданное газу
(QH
> 0) от нагревателя. По условию Т2
= Т4 = Т. Проанализируем, на
каких переходах газ получает тепло. На
изохорном переходе 1-2 температура
повышается пропорционально давлению,
а работа газом не совершается.
Следовательно, на участке 1-2 газ
получает тепло (Q12
> 0): Q12 = ∆U12
= 3/2Rv(T
– Т1). Здесь учтено, что газ
одноатомный, а следовательно, CV
= 3/2R.
На изобарном переходе 2-3 температура газа растет пропорционально повышению объема и, кроме того, газ совершает положительную работу. Следовательно, на участке 2-3 газ получает тепло (Q23 > 0): Q23 = ∆U23 + А23 = 3/2Rv(T – Т1) + vR(T3 - T). Здесь учтено, что при изобарном процессе работу газа можно определить как: А = р∆V = vR∆T.
Анализируя аналогично переходы 3-4 и 4-1, приходим к выводу, что на этих участках газ отдает тепло (Q34 < 0 и Q41 < 0).
Таким образом, газ за весь цикл получает от нагревателя количество теплоты, равное:
QH
= Q12 + Q23
= 3/2Rv(T
– Т1) + 3/2Rv(T
– Т1) + vR(T3
- T) =
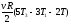 (1)
(1)
Определим, какую работу совершает газ за весь цикл. Газ совершает работу на изобарном переходе 2-3: А23 = vR(T3 - T) > 0 и на изобарном переходе 4-1: А41 = vR(T1 - T) < 0. Таким образом, работа газа равна: А = А23 + А41 = vR(T3 - T) + vR(T1 - T) = vR(Т3 – 2Т + Т1) (2)
В
выражении для Q и
для А неизвестной величиной является
температура Т в состояниях 2 и
3. На переходах 1-2 и 3-4 по
закону Шарля для изохорного процесса
справедливо:
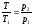 ;
;
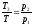 .
Здесь учтено, что р2 = р3
и р1 = р4. Тогда:
.
Здесь учтено, что р2 = р3
и р1 = р4. Тогда:
 .
Отсюда следует, что
.
Отсюда следует, что
 . Подставим найденное значение Т в
уравнения (1) и (2):
. Подставим найденное значение Т в
уравнения (1) и (2): ;
;
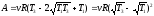
Таким
образом, КПД цикла равен:
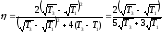 .
Самое главное в подобных задачах:
.
Самое главное в подобных задачах:
1) понимать, что поиск КПД тепловой машины можно искать по формулам:
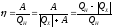
- важно сделать наиболее рациональный выбор, исходя из условий задачи.
2) выразить числитель и знаменатель через одни и те же физические величины, так как в результате должна получиться безразмерная величина.
64**.
А(1 – η)/η. 65**.
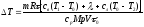 .
Подсказка. Поскольку охлаждение
воды начинается с Т1 = 293 К, то
очевидно, это и есть комнатная температура,
то есть температура нагревателя. Лед
охлаждается до температуры Т2
= 271 К – это и есть температура холодильника.
Нагревание воздуха в комнате происходит
при атмосферном давлении, которое можно
взять равным 100 кПа. Разберите пример
11.
.
Подсказка. Поскольку охлаждение
воды начинается с Т1 = 293 К, то
очевидно, это и есть комнатная температура,
то есть температура нагревателя. Лед
охлаждается до температуры Т2
= 271 К – это и есть температура холодильника.
Нагревание воздуха в комнате происходит
при атмосферном давлении, которое можно
взять равным 100 кПа. Разберите пример
11.
Пример 11. Идеальная машина, работающая по обратному циклу Карно, передает тепло от холодильника с водой при температуре Т1 = 0 оС кипятильнику с водой при температуре Т2 = 100 оС. Сколько воды нужно заморозить в холодильнике, чтобы превратить в пар mп = 1 кг воды в кипятильнике?
Решение.
Прежде всего, необходимо разобраться,
каковы температуры нагревателя и
холодильника тепловой машины. Очевидно,
температура холодильника равна
температуре замерзающей воды, то есть
Т1 = 0 оС. Температура
нагревателя равна температуре кипящей
воды Т2 = 100 оС. Поскольку
тепловая машина идеальная, работающая
по циклу Карно, то его КПД равен:
 .
С другой стороны, как у любой тепловой
машины КПД так же равен:
.
С другой стороны, как у любой тепловой
машины КПД так же равен:
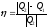 .
Но, поскольку машина работает по обратному
циклу (то есть как холодильная машина),
то Q2 < 0 – тепло,
передаваемое нагревателю, то есть в
нашем случае кипящей воде; Q1
> 0 – тепло, отбираемое у холодильника,
то есть у льда. (Напомним, что при работе
машины по прямому циклу Q2
> 0– рабочее тело забирает у нагревателя,
Q1 < 0 – отдает
холодильнику). Тепло, выделяемое при
замерзании воды и отбираемое машиной,
равно: Q1 = λmл;
тепло передаваемое нагревателю тратится
на парообразование воды: Q2
= Lmп. Таким
образом, мы имеем систему уравнений:
.
Но, поскольку машина работает по обратному
циклу (то есть как холодильная машина),
то Q2 < 0 – тепло,
передаваемое нагревателю, то есть в
нашем случае кипящей воде; Q1
> 0 – тепло, отбираемое у холодильника,
то есть у льда. (Напомним, что при работе
машины по прямому циклу Q2
> 0– рабочее тело забирает у нагревателя,
Q1 < 0 – отдает
холодильнику). Тепло, выделяемое при
замерзании воды и отбираемое машиной,
равно: Q1 = λmл;
тепло передаваемое нагревателю тратится
на парообразование воды: Q2
= Lmп. Таким
образом, мы имеем систему уравнений:
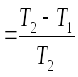
Решая систему относительно искомой величины mл, получаем результат:
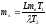 = 5 кг.
= 5 кг.
66. 153,7 МДж. 67. 557 кДж. 68. 2,2 кДж/(кг.К). Подсказка. Разберите пример 12.
Пример 12. В калориметр с теплоемкостью С = 60 Дж/К было налито воды массой m1 = 200 г при температуре t1 = 80 оС. В воду опустили кусочек льда массой m2 = 50 г с начальной температурой t2 = – 10 оС. Каково значение установившейся температуры системы?
Решение. В задачах, в которых идет речь о теплообмене тел, важно ответить на следующие вопросы.
Вопрос первый. Сколько тел участвуют в теплообмене? В данном случае – три тела: лед, вода и калориметр (так как задана его теплоемкость). Хотя конечно, окружающие тела так же участвуют в теплообмене, например, воздух и подставка под калориметром. Но калориметр имеет плохую теплопроводность, поэтому отдачей тепла окружающим телам можно пренебречь, тем более, что в условии задачи нам ничего неизвестно об окружающих телах. Поэтому будем считать, что система тел: калориметр – вода – лед – теплоизолированная система.
Вопрос второй. Какие тела отдают часть своей внутренней энергии (выделяют количество теплоты), а какие - приобретают (поглощают количество теплоты). В данном случае, очевидно, выделяют количество теплоты более нагретые вода и калориметр (справедливо полагать, что начальные температуры воды и калориметра одинаковы), а лед – поглощает как менее нагретое тело. В соответствии с законом сохранения энергии, выделенное количество теплоты одной частью тел равно поглощенному количеству теплоты другой частью тел теплоизолированной системы при условии, что тела в системе не производят механической работы: |Qводы| + |Q калорим| = Qльда (1).
Вопрос третий. К какому конечному результату вероятнее всего приведет процесс теплообмена между телами системы. Почему «вероятнее всего»? Дело в том, что результат теплообмена не всегда очевиден. Например, в нашем случае конечная температура системы может оказаться ниже нуля, если вся вода охладится до 0 оС, закристаллизуется и охладится до более низкой общей температуры системы. Но температура системы может оказаться и выше нуля, если лед нагреется до 0 оС, растает и нагреется до общей температуры системы. Поэтому важно проанализировать начальные параметры системы, чтобы предугадать наиболее вероятный результат теплообмена. По условиям задачи масса воды 200 г существенно больше, чем масса льда 50 г, да и начальная температура воды 80 оС существенно дальше отстоит от температуры ее кристаллизации 0 оС, чем начальная температура льда от температуры плавления. Вероятнее всего, конечная температура системы будет выше 0 оС.
Вопрос четвертый. Какие тепловые процессы происходят с телами в результате теплообмена? Если конечная температура системы будет выше 0 оС, становиться ясно, что вода и калориметр просто охладятся до конечной температуры, а лед, во-первых, охладиться до 0 оС, во-вторых, расплавиться при 0 оС, в-третьих, нагреется до конечной температуры, будучи уже в жидком состоянии.
Схематично, все ответы на поставленные вопросы изображены на рисунке 11.
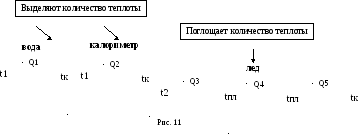
Тогда в уравнении теплового баланса с одной стороны будут стоять две порции количества теплоты, описывающие его выделение в результате охлаждения двух тел. С правой стороны будут стоять три порции количества теплоты, описывающие его поглощение одним и тем же телом в результате трех последовательных тепловых процессов, происходящих с этим телом: |Q1| + |Q2| = Q3 + Q4 + Q5 (2). Осталось расписать формулы расчета каждой порции количества теплоты. Необходимо отметить, что уравнение (2) записано в таком виде, при котором все порции Q берутся по модулю. Итак:
Q1 = cвm1(t1 – tк) – количество теплоты, выделяемое водой при ее охлаждении от температуры t1 до конечной температуры tк. Здесь из большего значения температуры t1 отнимается меньшее значение tк (мы определяем модуль Q).
Q2 = C(t1 – tк) - количество теплоты, выделяемое калориметром при его охлаждении от температуры t1 до конечной температуры tк. Здесь необходимо помнить, что С – это не удельная теплоемкость вещества, из которого изготовлен калориметр (тепловая характеристика 1 кг вещества), а теплоемкость тела - калориметра (тепловая характеристика всего тела). Теплоемкость тела равна количеству теплоты, которое необходимо сообщить всему телу для нагревания его на 1 оС (на 1 К);
Q3 = cлm2(tпл – t2) - количество теплоты, поглощаемое льдом при его нагревании от температуры t2 до температуры плавления tпл.
Q4 = λm2 - количество теплоты, поглощаемое льдом при его плавлении, которое происходит при одной и той же температуре плавления.
Q5 = cлm2(tк – tпл) - количество теплоты, поглощаемое водой, образовавшейся при плавлении льда, при ее нагревании от температуры плавления tпл до конечной температуры tк системы. Подставим все расшифрованные значения порций количества теплоты в уравнение (2):
cвm1(t1 – tк) + C(t1 – tк) = cлm2(tпл – t2) + λm2 + cлm2(tк – tпл) (3)
В уравнении (3) одна неизвестная величина – конечная температура tк. Решим это уравнение относительно неизвестной величины:
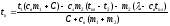
Осталось подставить числовые значения, взяв их в единицах системы СИ. Правда, размерность температуры совсем не обязательно брать в единицах системы СИ (в Кельвинах), так как в уравнении (3) везде идет речь об изменении температуры, а поскольку цены деления шкалы Цельсия и шкалы Кельвина совпадают, то изменение температуры так же будут иметь одинаковые значения по обеим шкалам.
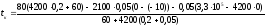 ≈
47 (оС)
≈
47 (оС)
69. 22 кг. Подсказка. В этой задаче система тел: дрова – снег – не является теплоизолированной. Необходимо учесть, что снег поглощает количество теплоты Qс, составляющее лишь 40 % от того количества теплоты Qд, которое выделяется при сгорании дров. Остальные 60 % поглощают окружающие тела (сосуд, в котором находится снег, окружающий воздух, опора под дровами и т.п.). С учетом этого уравнение теплового баланса будет записано: Qс = 0,4 Qд. Далее необходимо уточнить, из какого количества слагаемых будет состоять левая часть уравнения (исходя из ответа на вопрос: какие тепловые процессы будут происходить со снегом). 70*. 33,4 оС. 71.Нет, так как из-за теплообмена между каплей воды и массивным по сравнению с массой воды термометром погрешность измерения будет слишком велика (см. предыдущую задачу). 72. 89 оС. 73*. 55 оС. Подсказка. Эта задача типа «2 в 1». Решение этой задачи представляет собой описание с помощью уравнения теплового баланса двух этапов теплообмена: теплообмен в системе «вода – первое тело» и теплообмен в системе «вода – первое тело – второе тело». При этом необходимо понимать, что конечная температура воды и первого тела в результате первого этапа теплообмена являются одновременно начальной температурой при втором этапе теплообмена. Но в полученных двух уравнениях будут три неизвестные величины: масса воды, масса тела и конечная искомая температура. Тут вам необходимо вспомнить математические приемы, позволяющие комбинировать две неизвестные величины в одну. 74*. 23 г. Подсказка. Обратите внимание на выражение «мокрый снег». Оно означает, что вода в комке состоит частично из кристаллической фазы, а частично из жидкой фазы. При какой температуре это возможно? 75*. 0 оС; 400 г воды и 300 г льда. Подсказка. Анализируя начальные параметры системы, необходимо обратить внимание на то, что массы льда в 2,5 раза больше, чем воды. При таких условиях трудно с большой вероятностью предугадать результат теплообмена: то ли конечная температура будет ниже нуля (температуры плавления льда), то ли она будет выше нуля. В таких случаях разумно сделать предварительный расчетный анализ: рассчитайте, какое количество теплоты Q1 выделилось бы, если бы вся вода остыла до 0 оС, и какое количество теплоты Q2 необходимо, чтобы весь лед расплавился. Сравнив эти количества теплоты, можно прогнозировать результат теплообмена:
1) если Q1 > Q2, то, конечная температура будет либо выше нуля градусов и при этом весь лед растает, либо нулевой;
2) если Q1 < Q2, то конечная температура будет либо меньше нуля, и при этом вся вода закристаллизуется, либо нулевой. 76*. 3,5 кВт. Подсказка-напоминание. Конечно, в этой задаче количество теплоты, выделяемое горелкой, необходимо выразить через ее мощность. Очевидно, под мощностью в данном случае понимается количество теплоты, выделяемое горелкой за единицу времени. 77*. 60 мин. 78**. Нет. Подсказка. Плотность потока энергии показывает, какое количество энергии поступает за единицу времени к каждой единице площади, перпендикулярной лучам. Коэффициент отражения показывает, какая часть от поступаемой энергии отражается веществом (не поглощается им).
79**. 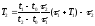 =
4,6 мин. Подсказка. Разберите пример
13.
=
4,6 мин. Подсказка. Разберите пример
13.
Пример 13. Электрический утюг с терморегулятором, установленным в положение «шерсть», нагревается до температуры t1 = 140 оС. При этом регулятор включает утюг на время τ = 30 с через промежутки времени Т1 = 5 мин. В положении регулятора «лен» утюг включается на то же время τ = 30 с через более короткие промежутки Т2 = 3 мин. Определить температуру t2 при регуляторе, установленном в положении «лен». Температура в комнате t0 = 20 оС.
Решение. Понятно, что в определенном положении терморегулятора температура утюга должна поддерживается практически постоянной, например, t1 = 140 оС в положении «шерсть». Это возможно, если получаемое утюгом количество теплоты Q1 в течение времени τ полностью компенсируют его потери Q2 в течение времени τ + Т1: Q1 = Q2. Количество теплоты Q1, получаемое утюгом за счет теплового действия электрического тока, очевидно равно: Q1 = ηРτ, где η – КПД термоэлемента, Р – мощность тока, τ – время прохождения тока. А вот, для определения количества теплоты Q2, теряемой утюгом, необходимы дополнительные рассуждения. Итак, мы встали перед вопросом, от чего зависит количество теплоты Q, отдаваемое нагретым телом окружающей среде. Очевидно, оно тем больше, чем больше время остывания Т. Интенсивность же остывания (теряемое количество теплоты за единицу времени), как показывает опыт, прямо пропорциональна разности температуры тела tт и температуры окружающей среды tср. Кроме того, очевидно, что интенсивность остывания зависит еще и от свойств самого тела, таких как размера его поверхности, цвета поверхности (белые поверхности остывают медленнее темных при прочих равных условиях), состава вещества, из которого изготовлено тело. Таким образом, передаваемое телом количество теплоты окружающей среде равно: Q = kT (tт - tср), где k – коэффициент пропорциональности различен для различных тел (его можно назвать коэффициентом теплоотдачи тела) и зависит от перечисленных свойств тела. Он имеет смысл количества теплоты, отдаваемого телом за единицу времени при разности температур тела и окружающей среды в 1 оС (1 К). Таким образом, потери утюгом количества теплоты за время τ + Т1 будут равны: Q2 = k (τ + Т1)(t1 – t0) (1). Итак, температура утюга в режиме «шерсть» будет постоянной и равной t1 , если выполняется условие: ηРτ = k (τ + Т1)(t1 – t0). Точно такие же рассуждения справедливы и для случая, когда терморегулятор находится в положении «лен»: ηРτ = k (τ + Т2)(t2 – t0) (2). Сравнивая уравнения (1) и (2), можно записать равенство: k (τ + Т1)(t1 – t0) = k (τ + Т2)(t2 – t0). Откуда, определяем температуру утюга t2 при регуляторе, установленном в положении «лен»:
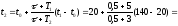 208,5
(оС).
208,5
(оС).
При подстановке числовых значений физических величин значение времени взято в минутах, так как в уравнении (3) время как множитель присутствует и в правой и в левой части уравнения в одной и той же 1-й степени (перевод его выражения в секунды привело бы к появлению одного и того же коэффициента 60 с/мин в той и другой части равенства). Значение температуры взято в градусах по Цельсию, а не в Кельвинах, так как и в левой и в правой части уравнения в качестве множителей стоит разность температур, значение которой одинаково и по шкале Цельсия и по шкале Кельвина в силу равенства их цен деления. Вопрос: можно ли было брать значение температуры в градусах по Цельсию, если бы в качестве множителей в левой и правой частях уравнения стояла не разность температур, а значения температуры тел?
80**.
8,5 м3. Подсказка. Для работы
лазера потребляется электрическая
энергия, которая частично преобразуется
в энергию лазерного излучения, а остальная
часть превращается во внутреннюю энергию
рабочего тела лазера, которое необходимо
охлаждать, чтобы оно не теряло своих
свойств. «Частота повторения импульсов
10 Гц» означает, что за каждую секунду
лазер излучает 10 импульсов. Сколько
импульсов он излучает за 1 час? 81**. 2,7
м/с. Подсказка. Очевидно, что при
скорости υ движения воды по трубе,
последний ее слой, который за время ∆t
успеет «проскочить» через произвольное
сечение трубы S, удален
от этого сечения в начальный момент
отсчета времени на расстояние υ∆t
(рис. 12). Таким образом, за время ∆t
через выделенное сечение успеет
«проскочить» вся масса ∆m,
заключенная перед сечением в объеме ∆V
= Sυ∆t,
то есть ∆m = ρSυ∆t.
82*. 7,5 м/с. Подсказка-замечание. Если Вы ищете плотность пара в физическом справочнике, то Вы зря потратили время, изучая предыдущий раздел «Основы молекулярно-кинетической теории». 83**. 13 % воды. Подсказка. Необходимо помнить, что жидкость превращается в пар не только при температуре кипения, но и при любой температуре путем испарения со свободной поверхности жидкости.. При испарении жидкость покидают молекулы, обладающие достаточной кинетической энергией для преодоления притяжения других молекул жидкости. Конечно, это должно приводить к понижению температуры жидкости (напоминаем, что температура – это мера средней кинетической энергии молекул вещества). Но температуру жидкости при этом можно поддерживать все-таки постоянной путем подвода к ней необходимого количества теплоты (специально или за счет внутренней энергии окружающего воздуха). Тогда можно говорить об удельной теплоте испарения жидкости как о количестве теплоты, необходимого для испарения 1 кг при постоянной температуре жидкости. Если же процесс испарения происходит без притока тепла извне, то, очевидно, при испарении каждого кг отбирается у жидкости именно то количество теплоты, которое равно удельной теплоте испарения, что приводит к ее охлаждению и, возможно, к кристаллизации (в зависимости от начальных условий: массы жидкости, ее начальной температуры). Понимая механизм испарения, не трудно догадаться, что чем выше температура жидкости, тем меньше удельная теплота испарения. 84**. -160 оС. Подсказка. Разберите пример 14.
Пример 14. При соблюдении необходимых предосторожностей вода может быть переохлаждена до температуры t1 = - 10 оС. Сколько льда образуется из такой воды массой m0 = 1 кг, если в нее бросить маленький кусочек льда и этим вызвать замерзание воды?
Решение. Прежде чем приступить к решению задачи, давайте выясним, как можно получить воду (жидкость) при температурах ниже 0 оС (ниже температуры кристаллизации). При достижении жидкости температуры кристаллизации начинается процесс роста кристалликов вокруг так называемых зародышей или центров кристаллизации. Разрастаясь все более, отдельные кристаллики в конце концов смыкаются друг с другом, образуя поликристаллическое тело. Центрами кристаллизации могут служить взвешенные в жидкости твердые частицы. Тщательно очищенную от таких частиц жидкость можно охладить ниже температуры кристаллизации без того, чтобы началось образование кристаллов. Состояние такой переохлажденной жидкости является метастабильным (неустойчивым). Обычно достаточно попасть в такую жидкость пылинке, для того чтобы она распалась на жидкость и кристаллы: образование кристалликов, сопровождающееся выделением тепла, будет происходить до тех пор, пока температура не поднимется до значения, при котором вещество может находиться как в жидком, так и в кристаллическом состоянии, то есть до температуры кристаллизации (плавления). Можно получить и перегретую воду (жидкость) при температурах выше 100 оС - выше температуры кипения при нормальном атмосферном давлении. Процесс бурного парообразования (кипения) начинается в пузырьки газа, растворенного в жидкости. Эти пузырьки газа образуются, прежде всего, на инородных включениях, например на песчинках. Если жидкость тщательно очистить от твердых включений и растворенных в ней газов, то путем нагревания ее можно довести до температуры, большей температуры кипения. Это и будет состояние перегретой жидкости. Такое состояние так же является метастабильным. Достаточно бросить в перегретую жидкость песчинку для того, чтобы жидкость вскипела.
А теперь приступим к решению задачи.
При попадании в переохлажденную воду любого инородного тела, в том числе и маленького кусочка льда, начинается процесс кристаллизации с выделением количества теплоты Q1 = λ∆m, где ∆m – масса образовавшегося льда. Выделяемое количество теплоты пойдет на нагревание воды и образовавшегося льда до температуры, при которой в сосуде могут находиться и вода и лед, то есть до температуры плавления tпл = 0 оС. Для такого нагревания воды потребуется количество теплоты, равное Q2 = cв(m - ∆m) (tпл – t0), а нагревание образовавшегося льда Q3 = cл∆m(tпл – t0) А так как система теплоизолированная, то полная ее энергия не изменится: Q1 = Q2 + Q3. Таким образом, получаем уравнение:
λ∆m = cв(m - ∆m) (tпл – t0) + cл∆m(tпл – t0), отсюда:
 ≈
0,12 (кг)
≈
0,12 (кг)
85*. На 120 К. Подсказка. Разберите пример 15.
Пример 15. Свинцовая пуля, летящая со скоростью υ1 = 400 м/с, попадает в свинцовую плиту и отскакивает от нее со скоростью υ2 = 300 м/с. Какая часть пули расплавится, если ее температура в момент удара была равна t1 = 107 оС и на нагревание пули пошло η = 0,8 всей работы, совершаемой при ударе? Удельная теплоемкость и удельная теплота плавления свинца равны соответственно с = 126 Дж/(кг . К) и λ = 25 кДж/кг. Температура плавления свинца равна 327 оС.
Решение. При ударе в свинцовую плиту над пулей совершается работа силой трения и силой, возникающей при неупругой деформации, в результате чего часть механической энергии пули превращается во внутреннюю энергию пули и свинцовой плиты. Пуля нагревается до температуры плавления и частично плавиться без теплообмена с окружающей средой, поскольку время удара бесконечно мало, и теплообмен не успеет произойти. При этом по условию задачи лишь η = 0,8 от потерянной механической энергии пули ушло на ее нагревание:
η|∆Емех| = |∆Uпули|, где:
|∆Емех|
=
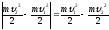 ;
|∆Uпули| =
сm(tпл
– t1) + λ∆m;
∆m – масса
расплавленной части пули. Таким образом,
имеем уравнение:
;
|∆Uпули| =
сm(tпл
– t1) + λ∆m;
∆m – масса
расплавленной части пули. Таким образом,
имеем уравнение:
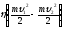 = сm(tпл
– t1) + λ∆m.
Отсюда:
= сm(tпл
– t1) + λ∆m.
Отсюда:
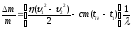 ≈ 0,05
≈ 0,05
86.
На 8 К. 87*. 94,7 Дж. 88*. ≈ 40 %. 89*.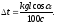 90*.1,68 . 10-4 Дж. 91*.
90*.1,68 . 10-4 Дж. 91*.
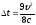 .
Подсказка. Не вся механическая энергия
превратиться во внутреннюю энергию
шаров. Для определения механической
энергии шаров после столкновения Вам
поможет закон сохранения импульса.
92**. ≈ 2,5 км/с;
.
Подсказка. Не вся механическая энергия
превратиться во внутреннюю энергию
шаров. Для определения механической
энергии шаров после столкновения Вам
поможет закон сохранения импульса.
92**. ≈ 2,5 км/с;
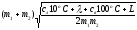 .
93**. 24,1 оС.
.
93**. 24,1 оС.
94**. Q =
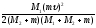 ≈
≈ .
Подсказка. Изменение импульса бруска
за малое время удара пули τ: ∆М2υ2
= Fуд .
τ, где Fуд –
сила удара (давления) пули о брусок.
Изменение импульса доски за это же время
τ равно: ∆М1υ1
= Fтр .
τ, где Fтр –
сила трения, с которой брусок действует
на доску. Очевидно, что Fтр
<< Fуд, а
значит: ∆М1υ1 <<
∆М2υ2. Следовательно,
изменением импульса доски во время
удара можно пренебречь, то есть можно
считать, что во время удара
весь передаваемый пулей импульс принимает
на себя только брусок. 95*. ≈ 35,5 т.
Подсказка. Разберите пример 16.
.
Подсказка. Изменение импульса бруска
за малое время удара пули τ: ∆М2υ2
= Fуд .
τ, где Fуд –
сила удара (давления) пули о брусок.
Изменение импульса доски за это же время
τ равно: ∆М1υ1
= Fтр .
τ, где Fтр –
сила трения, с которой брусок действует
на доску. Очевидно, что Fтр
<< Fуд, а
значит: ∆М1υ1 <<
∆М2υ2. Следовательно,
изменением импульса доски во время
удара можно пренебречь, то есть можно
считать, что во время удара
весь передаваемый пулей импульс принимает
на себя только брусок. 95*. ≈ 35,5 т.
Подсказка. Разберите пример 16.
Пример 16. Следуя по течению, пароход прошел некоторое расстояние по озеру со скоростью υ = 12 км/ч. Чему равна сила сопротивления воды движению парохода, если он сжигал mt = 120 кг угля в час? Чему равна полезная мощность, развиваемая двигателем? Коэффициент полезного действия паровой машины η = 10 %. Удельная теплота сгорания угля q = 29 МДж/кг.
Решение:
Решение подобных задач лучше всего
начинать с вопроса, что представляет
собой КПД двигателя. В данном случае,
коэффициент полезного действия паровой
машины, очевидно, равен отношению
полезной механической работы, совершаемой
силой тяги двигателя, к количеству
затрачиваемой при этом энергии топлива:
η =
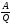 .
Важно при этом понимать, что в этой
формуле и А и Q
должны быть взяты за одно и тоже время
(или на одном и том же пути). Работа силы
тяги на пути s равна:
А = Fтяг.s.
Связать силу тяги с силой сопротивления
воды нам поможет второй закон Ньютона:
при равномерном движении парохода их
алгебраическая сумма равна нулю: Fтяг
– Fc
= 0. Отсюда А = Fc.s.
На этом пути сожжено угля: Q
= qmtt,
где t – время,
затраченное на прохождение пути s.
При скорости υ время, затраченное
на путь равно t = s/υ.
Таким образом, возвращаясь к определению
КПД машины, получаем уравнение:
.
Важно при этом понимать, что в этой
формуле и А и Q
должны быть взяты за одно и тоже время
(или на одном и том же пути). Работа силы
тяги на пути s равна:
А = Fтяг.s.
Связать силу тяги с силой сопротивления
воды нам поможет второй закон Ньютона:
при равномерном движении парохода их
алгебраическая сумма равна нулю: Fтяг
– Fc
= 0. Отсюда А = Fc.s.
На этом пути сожжено угля: Q
= qmtt,
где t – время,
затраченное на прохождение пути s.
При скорости υ время, затраченное
на путь равно t = s/υ.
Таким образом, возвращаясь к определению
КПД машины, получаем уравнение:
η
=
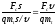 .
Решая это уравнение относительно искомой
величины Fc,
получаем ее значение:
.
Решая это уравнение относительно искомой
величины Fc,
получаем ее значение:
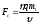 ≈ 104 (МН). 96*. 28 кВт. 97**.
≈ 104 (МН). 96*. 28 кВт. 97**.
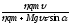
Список использованной литературы.
-
Курс общей физики. Савельев И. В., Издательство «Наука», Главная редакция физико-математической литературы, М., 1970.
-
Мякишев Г. Я. Физика: Молекулярная физика. Термодинамика. 10 кл.: Учебн. Для углубленного изучения физики/ Г. Я. Мякишев, А.З. Синяков. – М.: Дрофа, 2002.
-
Рымкевич А. П. Физика. Задачник. 10-11 кл. М.: Дрофа, 2000.
-
Балаш В. А. Задачи по физике и методы их решения: Пособие для учителя. М., «Просвещение», 1983.
-
Гольдфарб Н.И. Сборник вопросов и задач по физике: Учеб. пособие – М.; Высш. Школа, 1982.
-
Сборник задач по физике: Учеб. пособие/ Л. П. Баканина, В. Е. Белонучкин, С. М. Козел, И. П. Мазанько; Под ред. С. М. Козела. М.: Наука, 1990.
-
Тульчинский М. Е. Качественные задачи по физике в средней школе. Пособие для учителей. – М., «Просвещение», 1972.
-
Тульчинский М. Е. Занимательные задачи-парадоксы и софизмы по физике. М., «Просвещение», 1971.
-
Павленко Ю. Г. Тест – физика – тест. Специализированный учебно-научный центр МГУ. Школа имени А. Н. Колмагорова, 1993.
