
- •Кафедра "Инженерная химия и естествознание"
- •Гидролиз солей
- •Расчетная часть
- •Задания
- •Варианты заданий для предварительного расчета
- •Экспериментальная часть
- •Отчет о работе
- •Расчетная часть
- •Варианты заданий
- •Экспериментальная часть
- •Экспериментальное определение жесткости воды
- •Отчет о работе
- •С учетом значений их электродных потенциалов
- •Расчетная часть
- •Варианты для выполнения задания 1
- •Варианты для выполнения задания 2
- •Экспериментальная часть
- •Результаты исследования активности металлов в растворах солей
- •Результаты исследования активности металлов в растворах кислот
- •Результаты исследования влияния примесей в растворах на активность металлов
- •Отчет о работе
- •Химическая идентификация (обнаружение) и измерение содержания веществ
- •Идентификация некоторых ионов
- •Расчетная часть
- •Варианты задания по качественному анализу
- •Варианты задания к расчету по количественному анализу
- •Исходные данные для расчета (количественный анализ)
- •Экспериментальная часть
- •Результаты наблюдений (качественный анализ)
- •Результаты очистки растворов от опасных ионов (количественный анализ)
- •Отчет о работе
- •Произведения растворимости (пр) труднорастворимых веществ при 25 с
- •Потенциалы некоторых redox-систем
- •190031, СПб., Московский пр., 9.
Гидролиз солей
Цель работы – изучение реакций гидролиза различных типов солей по изменению рН, а также влияния концентрации растворов этих солей на рН, значение которого рассчитывается теоретически и проверяется экспериментально.
Реакция соли и воды в зависимости от природы соли протекает таким образом, что может превратить всю систему в кислоту или щелочь (в зависимости от изменения рН), что опасно для здоровья людей и долговечности материалов. Эти же реакции в определенных случаях могут быть и полезны. Такое превращение называют гидролизом. (Термин "гидролиз" произошел от греческих слов hydor – вода, влага и lysis – распад, разложение.)
Гидролиз можно определить как реакцию обменного взаимодействия ионов соли с молекулами воды, в результате которой смещается равновесие электролитической диссоциации воды, что и изменяет рН среды из-за образования малодиссоциированных молекул или ионов, а также труднорастворимых и летучих веществ.
Реакцию соли и воды оценивают по двум составляющим, отражающим природу соли, – силе кислоты и силе основания, из которых эта соль формируется. Понятие силы электролита отражает значение его константы диссоциации – Кд, которая является справочной величиной. Если значение Кд > 1 (в первом приближении), то электролит сильный, если Кд < 1 – слабый. Если обе составляющие соли принадлежат сильным кислоте и основанию, то реакции гидролиза не происходит и система остается нейтральной (рН ~ 7); во всех остальных случаях гидролиз происходит.
Реакция гидролиза экспериментально и качественно обнаруживается по смещению равновесия как с помощью индикаторов (веществ, приобретающих окраску в определенной среде), так и с помощью приборов (рН-метров). Индикаторы и рН-метры дают нам следующую информацию.
Если среда нейтральная (рН ~ 7), значит, в растворе данной соли равновесие диссоциации воды не смещено, т. е. соль гидролизу не подвергается; этот же случай наблюдается, когда обе составляющие соли образованы слабыми кислотой и основанием примерно одинаковой силы (Кд кислоты Кд основания).
Если среда кислая (рН < 7), значит, в растворе соли образуется избыток ионов водорода, т. е. протекает гидролиз по катиону (соль образована слабым основанием). Катион связывает гидроксид-ионы воды, а ионы Н+ накапливаются в растворе, придавая среде кислый характер.
Если среда щелочная (pH > 7), значит, в растворе соли образуется избыток гидроксид-ионов ОН–, т. е. протекает гидролиз по аниону (соль образована слабой кислотой). Анион связывает ионы Н+, а ионы ОН– накапливаются в растворе, придавая среде щелочной характер.
Гидролиз является обратимым процессом, на смещение равновесия которого влияют изменение концентрации соли, температура, изменение концентрации продуктов гидролиза, подкисление или подщелачивание раствора соли, разбавление раствора.
Одной из количественных величин, характеризующих гидролиз, является константа гидролиза Кг, которая связана с двумя другими константами – ионным произведением воды (Кв = 10–14) и константой диссоциации слабого электролита (или кислоты, или основания) Кд формулами:
Кг
=
![]() ,
(1)
,
(1)
Кг
=
![]() .
(2)
.
(2)
Кроме того, константа гидролиза связана с концентрацией соли (Ссоли) и концентрациями [OH–] и [H+] выражениями:
[OH–]
=
![]() =
=
![]() ,
(3)
,
(3)
[H+]
=
![]() =
=
![]() .
(4).
.
(4).
Зная Кг и/или Кд слабой составляющей соли, а также Ссоли, моль/л, можно рассчитать рН раствора, что бывает важно учитывать в инженерной практике, а также в знании экологической обстановки.
Так, например, соль Na2CO3 образована сильным основанием NaOH и слабой кислотой H2CO3 (Кд < 1, табл. 1.1), следовательно, гидролиз происходит и уравнение гидролиза соли имеет следующий вид по первой ступени:
молекулярное уравнение
Na2CO3 + H2O NaHCO3 + NaOH
ионное уравнение
CO32– + HOH HCO3– + OH–
константу гидролиза которого описывает формула
Кг
=
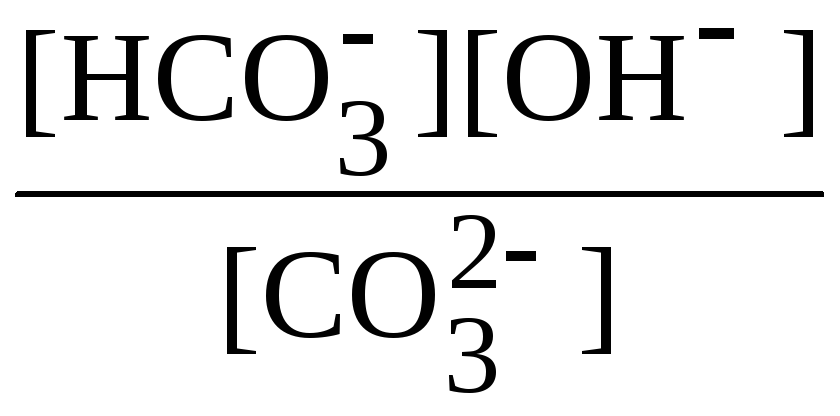 .
.
Для расчета константы гидролиза соли Na2CO3 с концентрацией, например 0,01 М, в состав которой входит анион слабой кислоты (H2CO3), а также рН раствора используем формулы (1) и (3):
Кг
=
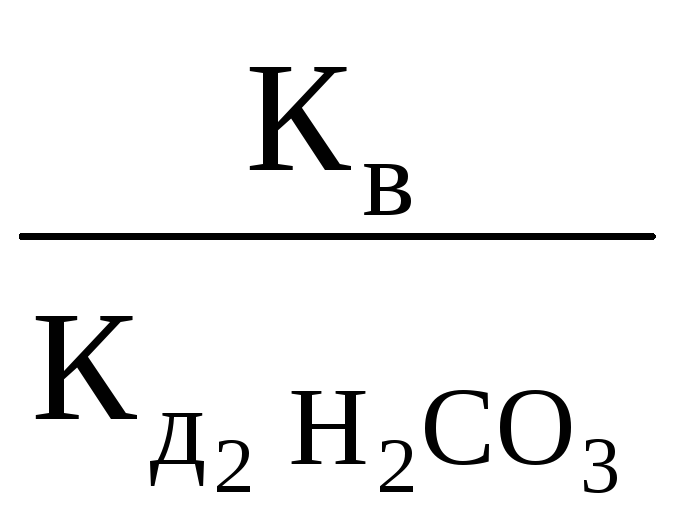 ;
;
[OH–]
=
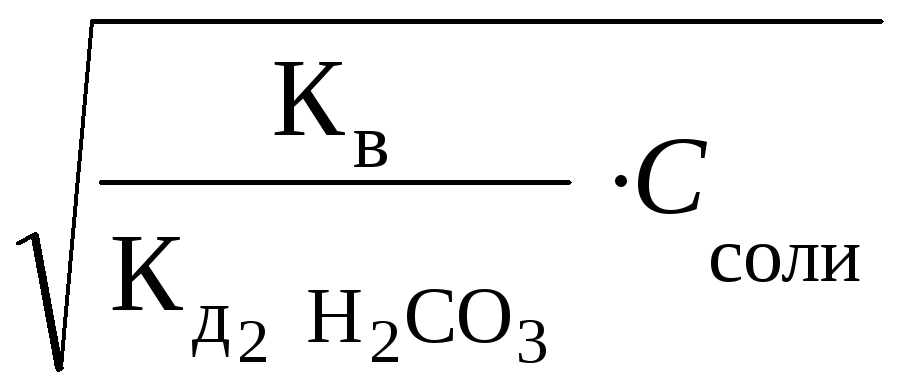 =
=
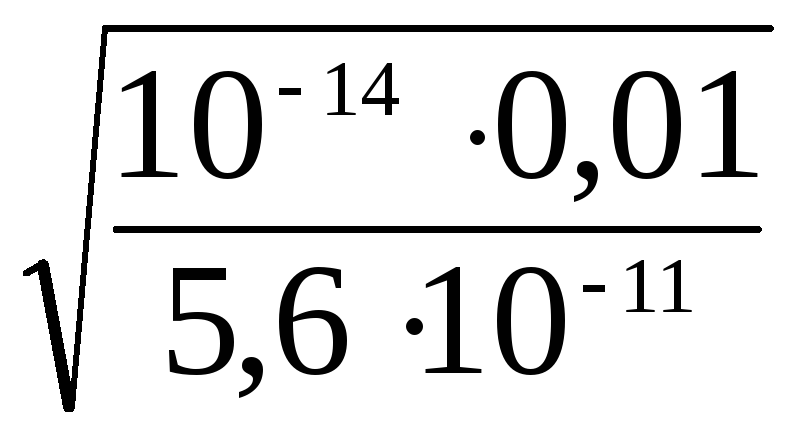 = 1,3·10–3
моль/л.
= 1,3·10–3
моль/л.
Выразим значение [H+] через ионное произведение воды:
Кв = [H+] [OH–] = 10–14 ,
откуда
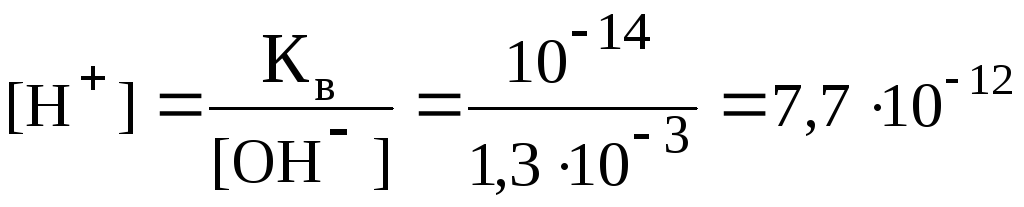 ,
рН = 12 – lg
7,7 = 11,3.
,
рН = 12 – lg
7,7 = 11,3.
Аналогично рассчитывается рН раствора соли другой заданной концентрации.
Если соль образована слабым основанием и сильной кислотой, то для расчета используются формулы (2) и (4).
Лабораторная работа включает в себя:
1) предварительную расчетную часть, которая выполняется заранее и является допуском к работе;
2) экспериментальную часть, куда входят приготовление раствора требуемой концентрации, а также инструментальные замеры соответствующих показателей на приборе;
3) сравнение результатов эксперимента с предварительными теоретическими расчетами;
4) отчет о работе.
