
- •Часть 1 (осенний семестр)
- •Глава 1 /семинары 1-3
- •Структура биологических молекул
- •Cлучайные блуждания и диффузия в связи со структурой
- •Глава 2
- •Энергетическая функция молекул
- •1. Запасание
- •2. Использование химической энергии
- •Проблема обеспечения стабильности энергетического эффекта гидролиза атф
- •3. Регуляция молекулярной активности
- •Молекулы как элементы системы регуляции и управления
- •Приложение
- •Каталитическая функция
- •Приложение 2.
3. Регуляция молекулярной активности
Выше рассмотрены примеры стабилизации концентрации АТФ как составной части гомеостаза. Поддержание постоянных концентраций – частный случай управления концентрациями химических компонентов клетки.
Общая проблема регуляции скоростей молекулярных процессов – обеспечить достаточное изменение скорости при воздействии, которое само может быть слабым. Поэтому требуется некоторое преобразование исходного стимула в изменение концентрации какого-то вещества (или т.п., например, 2-мерная концентрация, степень заполнения…) и его последующее усиление.
При этом решаются те же проблемы, что и при организации технических систем, и поэтому обсуждение можно вести в терминах теории управления: коэффициент усиления, устойчивость, контуры обратных связей и т.п. Например, коэффициент усиления – это отношение сигнала на выходе из устройства к сигналу на входе. Если входной и выходной сигналы – концентрации некоторых веществ, то коэффициент усиления – это отношение относительных изменений этих концентраций.
потребности и физико-химическая реализация
Молекулы как элементы системы регуляции и управления
В управлении скоростями молекулярных процессов использованы некоторые стандартные решения. Как правило, скорость и ход процесса регулирует, так или иначе, некоторая концентрация или воздействие на нее (например, энергетический обмен регулируется через концентрацию АТФ, как описано выше).
Молекула регулятора (c) может связаться с функциональной молекулой (обычно – белком, обозначим ее E), а от этого зависит ее активность. В предельном случае функциональная молекула активна в одном случае (например, при наличии связавшейся с ней молекулы регулятора, т.е в форме Ec) и неактивна в противоположном случае (т.е. в форме E).
Механизм, который обеспечивает такой результат – изменение пространственной структуры белка. Например, при связывании с регулятором становится возможной посадка реагирующих частиц в активный центр (в противном случае он недоступен для какой-то из взаимодействующих молекул).
Регуляция при связывании с одной молекулой регулятора
Если центр связывания один, то схема связывания
E + c = Ec
Связывание происходит за счет слабых взаимодействий типа электростатических, для которых энергия активации относительно мала, а поэтому его можно считать равновесным процессом (в отличие от регулируемого процесса, где энергия активации может быть весьма велика).
В этом случае скорости прямого и обратного процессов равны (k+[E]c = k–[Ec], где k+ и k– - константы скорости прямого и обратного процессов, K = k+/k– - константа равновесия, c одновременно обозначает само вещество и его концентрацию) и есть общая связь концентраций [E] + [Ec] = E0. Из этих условий можно выразить концентрацию активной формы белка (например, действующей как фермент переносчик, сократимый белок…).
[Ec] = Kc[E] = E0 Kc /(1 + Kc )
Тогда скорость регулируемого процесса будет пропорциональна этой концентрации (если не предусмотрена некая более сложная регуляция).
Иными словами, в этом простейшем случае типовая зависимость скорости процесса от концентрации регулятора – гиперболическая.
Можно показать, что гиперболическая зависимость дает достаточно слабое усиление малого изменения концентрации регулятора. Обозначим [Ec] = y (в данном случае она пропорциональна скорости регулируемого процесса). Относительное изменение концентрации активной формы белка при относительном изменении концентрации регулятора c (это и есть коэффициент усиления) U = (dy/y)/(dc/c) = d[ln(y)]/d[ln(c)]. Для гиперболической зависимости вида y =c/(a+c) производная d[ln(y)]/dc = 1/c – 1/(a+c). Для нее отношение U = (dy/y)/(dc/c) = 1 – c/(a+c), т.е. коэффициент усиления меньше единицы (близок к единице при малых концентрациях регулятора, уменьшаясь до нуля с ростом c, причем значительно меньше единицы уже при a>>c).
Иными словами, ясно, что усиление малого изменения концентрации регулятора в данном случае достаточно слабое (низкий коэффициент усиления с этой точки зрения).
Если же напротив, активная форма [E] (тогда с – это ингибитор), то
Такое свойство для схемы связывания с одной молекулой регулятора не изменяется также, если активной формой является свободная форма, которой отвечает концентрация [Ec] (а не [Ec], как выше).
А требуется и фактически часто осуществляется очень резкое переключение. Например, у мухи при переходе к полету и уменьшении АТФ на 10% наблюдается 100-кратное увеличение скорости гликолиза, т.е. в данном случае реальная система регуляции обеспечивает коэффициент усиления, равный 1000.
Во многих других ситуациях реальной жизнедеятельности коэффициент усиления необходим высокий (в сравнении с единицей как стандартном отсутствия усиления), в предельном случае зависимость скорости процесса от концентрации регулятора – ступенчатая.
кооперативное усиление:
количественное описание
=Формальное рассмотрение в терминах констант равновесия и констант скоростей
Регуляция при связывании с несколькими молекулами регулятора
Увеличение восприимчивости к изменению регулирующей концентрации обеспечивается за счет связывания функциональной молекулы со многими молекулами регулятора (причем активна лишь одна форма, например, полностью свободная от регулятора, или, напротив, связанная с максимально возможным числом молекул регулятора).
Выражение для эффекта регуляции дает рассмотрение примера
При наличии 4-х центров связывания последовательность этапов связывания следующая
![]()
![]()
![]() …
…![]()
Отдельные этапы связывания описываются уравнениями, аналогичными выведенному и использованному выше для одной молекулы регулятора (). Для первого этапа
k1[E]c = k–1[Ec] , тогда [Ec] = K1c[E]
Для последующих этапов
[Ec2] = K2c[Ec] = K2K1c2[E]
[Ec3] = K3c[Ec2] = K3K2K1c3[E]
[Ec4] = K4c[Ec3] = K4K3K2K1c4[E]
Отсюда, учитывая баланс [E] + [Ec] + [Ec2] + [Ec3] + [Ec4] = E0, получим выражение для относительной доли активной формы фермента, связанного с 4-мя молекулами регулятора
Y = [Ec4]/ [E] + [Ec] + [Ec2] + [Ec3] + [Ec4] =
= K4K3K2K1c4/(1 + K1c + K2K1c2+ K3K2K1c3+ K4K3K2K1c4).
Более точное выражение для микроскопических констант связывания
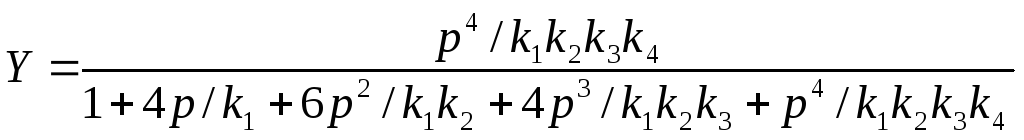 ()
()
Оно позволяет получить выражение при равенстве констант как гиперболическую зависимость в соответствующей степени. Из него ясно, что при равенстве констант коэффициент усиления не возрастает.
Коэффициент усиления можно существенно увеличить за счет различия констант, когда следующее связывание зависит от предыдущего (см. например, для гемоглобина в части 2).
Способ существенно увеличить усиление при связывании с несколькими центрами – это наличие двух форм свободного фермента (напряженного и ненапряженного состояний).
Для схемы связывания
![]()
![]()
![]()
![]() …
…![]()
вывод зависимости от выражения для насыщения активной формы
![]() =…
()
=…
()
усиление химического сигнала
Эффект регуляции характеризуют, с одной стороны, коэффициент усиления, а с другой стороны, полнота использования потенциальной производительности регулируемого белка или молекулярного комплекса (важно, чтобы синтезированный белок использовался, т.к. иначе он бесполезно занимает часть объёма клетки и разрушается со временем).
Полноту использования потенциальной производительности выражает непосредственно Y: при малом Y работает лишь небольшая часть регулируемого белка.
Значение коэффициента усиления непосредственно из полученных общих формул для связывания с несколькими молекулами регулятора (в соответствие с его определением) выражать неудобно в силу громоздкости вычислений и необозримости результата.
Зависимость степени насыщения от двух основных факторов: числа молекул регулятора и наличия релаксированного состояния, можно получить, считая одинаковыми константы равновесия для различных этапов присоединения субстрата.
Тогда выражению для степени насыщения (которая в общем виде позволяет представить многие возможности регуляции, обсуждаемые в РМ, Биофизике и т.д.)
![]() ,
,
где:
-
произведение KS обозначено как a (где ki/k–i = K);
-
константа для перехода между ненапряженной и напряженной конформациями белкового комплекса обозначена как L = k+/k– ;
-
учтена комбинаторика с точки зрения возможностей заполнения свободных мест связывания при соответствующем числе уже заполненных – РМ, с. ; Биофизическая химия, с. ).
Наличие ненапряженного состояния (которое дает слагаемое L в знаменателе) обеспечивает многие возможности регуляции. Удобно сразу рассмотреть случай L >> 1, т.к. промежуточные значения L дают промежуточные возможности в сравнении с малыми L (т.е. практическим отсутствием такого состояния), когда многие возможности регуляции отсутствуют, в чем легко убедиться, проведя вычисления.
Графически зависимости при различных значениях L и n = 4, а также L = 1000 при n = 2,3,4 представлены на рисунке 1?.
Эффект различия констант можно проанализировать на простейшем случае двух центров связывания (с двумя молекулами регулятора).
Важная промежуточная задача: какую степень сигмоидности можно обеспечить в схеме с двумя этапами
В рассматриваемых схемах наибольшее значение коэффициента достигается на степенном участке зависимости Y(c), где абсолютное значение степени насыщения относительно невелико, т.е. доля активных молекул белка невелика. Тогда регулируемая скорость далека от максимального значения, а значит, эффективность его использования не высока.
Следствие: в простых схемах коэффициент усиления низкий, если стоит задача не терять максимальных значений
Общий вывод: в простых схемах трудно обеспечить высокое усиление без потери эффективности, отсюда при потребностях в большом усилении сложные энергозатратные решения (футильные циклы, каскады и т.д.)
более дорогой способ еще больше увеличить усиление – вычитание скоростей противоположно направленных процессов, каскады или некоторая специфическая кооперативность
наблюдаемое решение:
простые варианты: обратная связь по субстрату или продукту – например, конкурентное и неконкурентное ингибирование,
Выше обсуждалась регуляция за счет участия нескольких одинаковых молекул регулятора. Физико-химические взаимодействия с участием нескольких или многих одинаковых молекул (особенно, если присоединение к образующемуся комплексу одной из таких молекул влияет на присоединение другой или других молекул) называют кооперативными.
Другой вариант кооперативного связывания – это связывание с агрегатами регулятора (димерами, тетрамерами…), которые используются при регуляции у бактерий и вирусов. Например, для бактериофага лямбда – регуляция гена, кодирующего белок-репрессор лизиса бактериальной клетки-хозяина, за счёт связывания с димером репрессора.
Лактозный оперон кишечной палочки регулируется тетрамером из 4-х молекул репрессора (регуляцию определяет также димерное связывание с цАМФ). Мономер репрессора способен связываться с лактозой и в этом состоянии неактивен
R + L RL, KL
В ответ на изменение концентрации лактозы в среде (а с ней и изменении ее концентрации в клетке) изменяется концентрация репрессора в активной форме (т.е. тетрамера), в результате увеличение концентрации лактозы уменьшает концентрацию свободного репрессора и его тетрамера, что увеличивает экспрессию лактозного оперона.
Насколько существенно изменяется концентрация тетрамера (как активной формы репрессора) в ответ на изменение концентрации лактозы, можно оценить, пользуясь уравнением материального баланса для репрессора в различных формах
R0 = R (1+ L) + R4
и считая для простоты, что связывание мономеров представлено единственным процессом
4R R4, K4R.
Удобно проводить расчеты в представлении, где значения констант равновесия численно равны единице (т.е. KL = 1, K4R = 1). Рассмотрим 10-кратное изменение концентрации лактозы (в условных единицах – также для удобства), т.е.
L: 1 (исх) 10 (конечн)
Тогда можно оценить эффект изменения концентрации тетрамера через различие исходная и конечная концентрация репрессора – соответственно Rисх и Rконечн
|
Rисх |
R0 |
Rконечн |
Rисх4 |
Rконечн4 |
Rисх4/Rконечн4 |
|
2 |
20 |
1,4 |
16 |
4,6 |
3,4 |
|
1 |
3 |
3/11 |
1 |
(3/11)4 |
(11/3)4200 |
|
0,5 |
1,0625 |
~1/10 |
1/24 |
(1/10)4 |
54 625 |
R0/(1+L)
Задание. Рассмотрите аналитически данную задачу регуляции. Что является коэффициентом усиления в данном случае? Какая функция (в явном или неявном виде) дает зависимость коэффициента усиления от концентрации лактозы и других факторов. Как можно выразить целесообразность с точки зрения регуляции работы лактозного оперона (если сможете, попробуйте сформулировать количественное утверждение в этой связи)? Представьте графически важные с Вашей точки зрения зависимости.
