
- •Содержание
- •Общие методические указания
- •Лабораторная работа № 2 Определение молярной массы эквивалента цинка
- •Вещества реагируют друг с другом в равных количествах эквивалентов .
- •Лабораторная работа № 3
- •Теоретические пояснения
- •Методика проведения опытов
- •I. Оксиды их получение и свойства
- •II. Гидроксиды, их получение и свойства
- •Опыт 2: Получение нерастворимого основания
- •Необходимый уровень подготовки студентов
- •Уметь писать уравнения реакций, отражающие химические свойства оксидов и гидроксидов.
- •Лабораторная работа № 4
- •Теоретические пояснения
- •Методика проведения опытов
- •I. Кислоты, их получение и свойства
- •I. Соли, их получение и свойства
- •Опыт 5: Получение солей взаимодействием двух солей
- •Необходимый уровень подготовки студентов
- •4. Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •Лабораторная работа № 5 Кинетика химических реакций
- •Лабораторная работа №6 Химическое равновесие
- •Лабораторная работа №7 Приготовление растворов заданной концентрации
- •Лабораторная работа № 8 Малорастворимые электролиты. Произведение растворимости
- •Пашаян арарат александрович
- •Методические указания по выполнению лабораторных работ (№1 - № 8) и организации подготовки к их защите студентами I курса специальностей 270800 - «Строительство»
4. Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
-
Составьте формулы средних и кислых бариевых солей следующих кислот: H2SO4; H2S; H3PO4; H2SO3; H2C2O4; H2Cr2O7. Назовите эти соли.
-
Изобразите графические формулы следующих солей: MgSO3; Ca(HCO3)2; Na2HPO4; (CuOH)2SO4; (CuOH)2CO3; KaAl(SO4)2; KFe[Fe(CN)6]. Назовите эти соли.
-
Определите класс и назовите соли: Al(OH)Cl2; (CuOH)2CO3; Bi(OH)2NO3; ZnOHCl; Ca3(PO4)2; CaHPO4; Ca(H2PO4)2.
-
Назовите следующие соли железа и напишите их графические формулы: Fe2(SO4)3; FeOHCl; [Fe(OH)]2SO4; FeHPO4’ FeOHSO4.
-
Составьте формулы следующих солей: дигидрофосфат кальция, гидрокарбонат кальция, сульфат гидроксоалюминия, сульфит бария, сульфид бария, гидросульфид бария.
-
Составьте формулы всех кальциевых солей фосфористой кислоты и назовите их.
ЛИТЕРАТУРА
-
Курс общей химии/Под ред. Н.В.Коровина.-М.:Высш.шк., 1990.
-
Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. Сборник задач и упражнений по общей химии.-М.:Высш. шк., 19991.
3. Химия:Справ.изд/В.Шретер, К.-Х.Лаутеншлегер, Х.Бибрак и др.: Пер. с нем.– М.: Химия, 1997.
Лабораторная работа № 5 Кинетика химических реакций
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры .
Оборудование и реактивы: химический стакан, термометр, штатив с пробирками, электроплитка, лучина, дистиллированная вода, 0,1М раствор НС1, 1,0 н, раствор H2SO4, 0,05 н раствор Na2S2O3, мел.
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Кинетика – наука о скорости химических реакций. Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Скорость реакции зависит от ряда факторов: природы реагирующих веществ, концентрации реагирующих веществ, температуры, наличия катализатора.
1) Зависимость скорости реакции от концентрации выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
Н2(г) + I2 (г) → 2HI(г)
закон
действующих масс может быть записан
![]() где
где
![]() —
скорость химической реакции;
—
скорость химической реакции;
![]() —
константа скорости;
—
константа скорости;![]() и
и
![]() концентрации
реагирующих веществ.
концентрации
реагирующих веществ.
Реакции в гетерогенной системе осуществляются на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела. Так, для реакции:
С(к) + О2(г) → СО2(г)
закон
действующих масс имеет вид
![]() где
где
![]() -
константа скорости;
-
константа скорости;
![]() -
концентрация кислорода; S
- площадь поверхности раздела между
фазами.
-
концентрация кислорода; S
- площадь поверхности раздела между
фазами.
2) Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
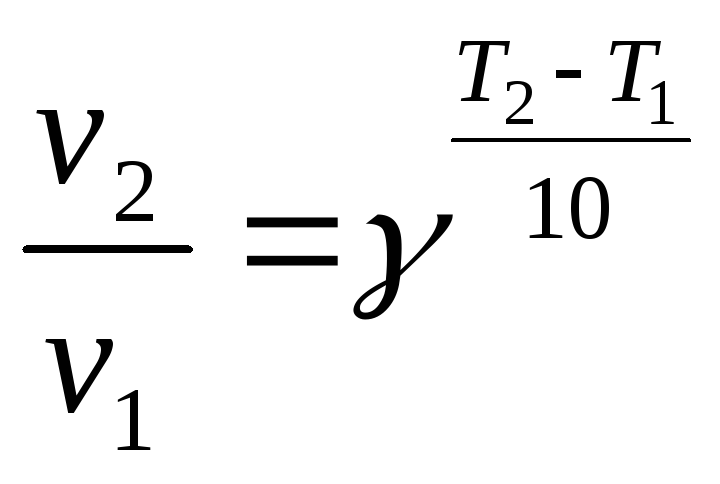
где
v1
и v2
скорости
реакции при Т2
и Т1,
![]() -
температурный коэффициент, показывающий,
во сколько раз увеличивается скорость
реакции при повышении температуры на
10 оС.
-
температурный коэффициент, показывающий,
во сколько раз увеличивается скорость
реакции при повышении температуры на
10 оС.
3) Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
Опыт 1 Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ изучают на примере взаимодействия тиосульфата натрия с серной кислотой:
Nа2S2О3 + Н2S04 = S02 + Nа2S04 + H2O + S
Признаком реакции является помутнение раствора вследствие выделения серы.
Заполните три бюретки: первую – 1н раствором Н2S04, вторую – 0,05 н раствором Nа2S2О3, третью — водой. Приведите бюретки в рабочее положение.
Налейте в три пробирки из бюретки по 1 мл Н2S04. В другие три пробирки из бюреток налейте: в первую — 1 мл раствора Nа2S2О3 и 2 мл воды; во вторую –2 мл раствора Nа2S2О3 и 1 мл воды; в третью – 3 мл раствора Nа2S2О3 и 0 мл воды.
Заметив время, в первую пробирку прилейте из пробирки 1 мл отмеренного раствора серной кислоты и быстро перемешайте полученную смесь. Отметьте время начала помутнения раствора. Проделайте то же самое с двумя оставшимися пробирками.
Рассчитайте vпракт для второго и третьего случаев, учитывая, что скорость реакции и время протекания реакции до начала помутнения раствора обратно пропорциональны. Следовательно:
![]()
где v1 – скорость реакции в первом случае (v1 = 1); v2 – скорость реакции во втором (третьем) случае; τ1 – время протекания реакции до начала помутнения раствора в первом случае, с; τ2 – время протекания реакции до начала помутнения раствора во втором случае, с.
Результаты опыта внесите в табл. 1.
Таблица 1.
|
№ п/п
|
Объем, мл |
Относительная концентрация
|
Температура опыта, °С
|
Время начала помутнения, с
|
Относительная скорость реакции
|
|||
|
H2S04
|
Н2О
|
Na2S2O3
|
vтеор
|
vпракт
|
||||
|
1
|
1
|
2
|
1
|
1
|
комнатная
|
|
1
|
1
|
|
2
|
1
|
1
|
2
|
2
|
комнатная
|
|
2
|
|
|
3
|
1
|
0
|
3
|
3
|
комнатная
|
|
3
|
|
Опыт 2 Зависимость скорости реакции от температуры.
Зависимость скорости реакции от температуры изучают на примере реакции
Nа2S2О3 + Н2S04 = Nа2SО4 + S02 + H2O + S
По правилу Вант - Гоффа (при γ = 1,8) получаем, что при повышении температуры на 10° скорость реакции увеличится в 1,8 раза, на 20° - в 3,24 раза, на 30° - в 5,832 раза и т.д.
Приведите бюретки с растворами Nа2S2О3, Н2S04 и водой в рабочее положение.
В две пробирки из бюретки прилейте по 1 мл Н2S04. В две другие пробирки из бюреток прилейте по 1 мл раствора Nа2S2О3 и по 2 мл воды.
Одну пару пробирок (одна пробирка с Н2S04, другая с 1 мл Nа2S2О3 и 2 мл воды) поместите в стакан с горячей водой с температурой на 10° выше комнатной. Через 5-7 мин, когда растворы нагреются до нужной температуры, смешайте их и определите время помутнения раствора, как в опыте 1.
Другую пару пробирок поместите в термостат с температурой на 20о выше комнатной. Через 5-7 мин смешайте растворы и определите время начала помутнения.
Рассчитайте vпракт для второго и третьего случаев (методика расчета дана выше). На миллиметровой бумаге постройте кривую зависимости vтеор от температуры. На этом же графике отметьте значения vпракт.
Рассчитайте значение температурного коэффициента γпракт исходя из опытных данных.
Результаты опыта запишите в табл. 2. (экспериментальные данные для комнатной температуры возьмите из опыта 1, № п/п 1).
Таблица 2.
|
№ п/п |
Объем, мл |
Общий объем, мл |
Температура опыта, 0С |
Время начала помутнения , с |
Относительная скорость реакции |
||||
|
H2S04 |
Н2О |
Na2S2O3 |
vтеор |
vпракт |
|||||
|
1 |
1 |
2 |
1 |
4 |
комнатная |
|
1 |
|
|
|
2 |
1 |
2 |
1 |
4 |
комнатная +10 |
|
1,8 |
|
|
|
3 |
1 |
2 |
1 |
4 |
комнатная + 20 |
|
3,24 |
|
|
Опыт 3 Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе (полумикрометод)
а) Взаимодействие карбоната кальция с соляной кислотой. Приготовьте два небольших приблизительно одинаковых кусочка мела. Один из них разотрите пестиком на листе бумаги и пересыпьте в коническую пробирку, второй поместите в другую пробирку. В обе пробирки одновременно добавьте по 15-20 капель концентрированной соляной кислоты. Напишите уравнение реакции. Отметьте наблюдаемые явления и объясните их.
Опыт 4 Зависимость скорости реакции от природы реагирующих веществ.
В две пробирки поместите примерно одинаковые промытые водой кусочки цинка. В первую пробирку прилейте 0,1 М раствора HCI, в другую 0,1 М раствора уксусной кислоты. Отметьте, в какой из пробирок газ выделяется более интенсивно. Чем объяснить различную скорость выделения водорода в первом и во втором случаях? Напишите уравнения реакций взаимодействия цинка с уксусной и соляной кислотами.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1 Вычисление скорости реакции по концентрациям реагирующих веществ.
Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2∙моль -2∙с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества В.
Решение
Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для уравнения реакции в нашем примере
![]()
Скорость химической реакции в начальный момент равна
v = 0,5∙ 6 2 ∙5 = 90,0 моль ∙с -1∙ л -1
По истечении некоторого времени в реакционной смеси останется 45 % вещества В. т. е. концентрация вещества В станет равной 5,0∙0,45= 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 - 2,25= 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества А уменьшилась на 5,5 моль/л (2,75∙ 2) и стала равной 0,5 моль/л (6,0 - 5,5). Следовательно, v2 = 0,5∙(0.5)2 ∙ 2,25 = 0,28 моль∙с -1∙л -1.
Пример 2
Как изменится скорость прямой реакции 2СО + О2 = 2СО2 если общее давление в системе увеличить в 4 раза?
Решение
Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Согласно закону действующих масс начальная скорость реакции равна
![]()
после увеличения давления
![]()
![]()
После увеличения давления в 4 раза скорость реакции возросла в 64 раза.
НЕОБХОДИМЫЙ УРОВЕНЬ ПОДГОТОВКИ СТУДЕНТОВ
1. Знать понятия: скорость химической реакции, катализ и катализатор, константа скорости химической реакции, энергия активации, порядок реакции.
2. Знать факторы, влияющие на скорость химической реакции.
3. Уметь выражать связь между скоростью реакции и концентраций реагирующих веществ на основе закона действующих масс.
4.Знать правило Вант - Гоффа, уметь применять его для нахождения скорости химической реакции при повышении температуры на определенное число градусов.
ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. Что называют скоростью химической реакции? От каких факторов она зависит?
2. Как и почему изменяется скорость химической реакции при изменении температуры?
3. Что называют энергией активации?
4. От каких факторов зависит скорость химической реакции в гетерогенных системах?
5. Что называют катализатором? Какое влияние и почему оказывает катализатор на скорость химической реакции?
6. Что называют порядком реакции? Запишите кинетическое уравнение для реакции первого порядка.
7. Изобразите графически зависимость IgC от t для реакции первого порядка.
8. Константа скорости реакции А + 2В = ЗС равна 0,6 л2∙ моль -2∙с -1. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация вещества А и скорость прямой реакции?
9. На сколько градусов нужно повысить температуру, чтобы скорость реакции
возросла в 90 раз? Температурный коэффициент равен 2,7.
ЛИТЕРАТУРА
1. Коровин Н.В. Общая химия .-М.: Высш.шк., 2000.-С. 167-203.
2. Романцева Л.М., Лещинская З.Л, Суханова В.А. Сборник задач и упражнений по общей химии - М.: Высш. шк., 19991.-с. 74-91.
