
- •Основы химической термодинамики, кинетики, равновесия и электрохимии
- •1. Основные закономерности протекания химических реакций
- •1.1. Энергетика химических реакций
- •1.2. Направленность химических процессов
- •2. Основы химической кинетики
- •2.1. Скорость химической реакции
- •2.2. Химическое равновесие
- •2.3. Смещение химического равновесия
- •3. Основы электрохимии
- •3.1. Гальванический элемент
- •3.2. Коррозия металлов и методы защиты от коррозии
- •3.3. Электролиз
- •Список литературы
- •Содержание
- •1. Основные закономерности протекания химических реакций 1
- •Энергетика химических реакций 1
- •Основы химической термодинамики, кинетики, равновесия и электрохимии
2.2. Химическое равновесие
Реакции, идущие одновременно в двух противоположных, направлениях (прямом и обратном), называют обратимыми. Для любой обратимой гомогенной реакции:
аА + вВ сС -dD.
В
начальный момент времени, согласно
закону действующих масс,
скорость прямой реакции:
![]() =
=
![]() ∙CaA-CbB
, имеет максимальное значение, а
скорость обратной реакции
∙CaA-CbB
, имеет максимальное значение, а
скорость обратной реакции
![]() =
=
![]() -Ccc-DdD
равна
нулю. Со временем концентрация исходных
веществ - реагентов
(А и В) уменьшается, а продуктов реакции
(С и D)
возрастает
и, следовательно, уменьшается скорость
прямой и возрастает скорость
обратной реакции. Наступает момент,
когда обе скорости становятся
равными (
-Ccc-DdD
равна
нулю. Со временем концентрация исходных
веществ - реагентов
(А и В) уменьшается, а продуктов реакции
(С и D)
возрастает
и, следовательно, уменьшается скорость
прямой и возрастает скорость
обратной реакции. Наступает момент,
когда обе скорости становятся
равными (![]() =
=![]() ), что соответствует равновесному
состоянию
системы. Концентрации реагентов и
продуктов реакции, установившиеся
к моменту равновесии, называются
равновесными [А],
[В], [С], [D],
они остаются постоянными до нарушения
химического
равновесия.
), что соответствует равновесному
состоянию
системы. Концентрации реагентов и
продуктов реакции, установившиеся
к моменту равновесии, называются
равновесными [А],
[В], [С], [D],
они остаются постоянными до нарушения
химического
равновесия.
Равновесное состояние химической системы характеризуется по закону действующих масс константой равновесия (Кр).
13
Для гомогенной реакции в общем виде выражение Кp имеет вид:
![]()
Это выражение позволяет рассчитать Кp по известным равновесным концентрациям всех веществ гомогенной реакции или концентрацию отдельного из веществ по известным концентрациям остальных веществ и КР.
Для гетерогенных реакций в выражение константы равновесия не входят концентрации веществ, находящиеся в конденсированном состоянии ввиду их постоянства. Для гетерогенной обратимой реакции в общем виде:
аА(г) + вВ(к) сС(к) +dD(г) выражение для константы равновесия имеет вид:
![]()
Например, для гетерогенной реакции
С
Для реакции
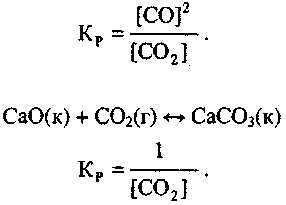
При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентрации реагентов на величины СА и СВ и увеличение концентраций продуктов на величины СС и Со, определяемые выражениями для реагентов:

где С0,(А), С0,(B), С0,(C), С0,(D) - исходные концентрации реагентов и продуктов реакции. Эти выражения позволяют рассчитать равновесные концентрации веществ по начальным концентрациям реагентов при известном значении Кр (и наоборот).
14
Пример 1. При некоторой температуре константа равновесия реакции: Н2 (г) + I2 (г) 2HI (г) равна 1. Определите состав равно- весной реакционной смеси, если для реакции были взяты 1 моль/л Н2 и 2 моль/л I2.
Решение. Задача сводится к определению равновесных концентраций реагентов и продуктов реакции через константу равновесия. Запишем выражение константы равновесия:
![]()
Равновесные концентрации представляют собой концентрации реагентов, не вступивших в реакцию к моменту установления равновесия, и концентрации продуктов реакции, образовавшихся к моменту равновесия. Эти концентрации можно рассчитать из уравнения реакции:
Н2 (г) +I2 (г) 2HI (г).
Начальная концентрация: 1 2 0
К моменту равновесия:
1) прореагировало, ∆С х х
2) осталось 1-х 2-х
3) образовалось 2х
Таким образом, равновесные концентрации исходных веществ и продуктов реакции составляют:
[H2] = CH2-x = (l-x),
[I2] = С12-х = (2-х), .
[HI] = 2х, так как из уравнения видно, что HI образуется в 2 раза больше, чем реагирует Н2 или I2. С0,(H2) и С0, (12) - исходные концентрации Н2 и I2.
15

(второй корень уравнения является отрицательным и физического смысла не имеет).
По достижении равновесия состав реакционной смеси был следующий:
[Н2] = (1 - 0,45) = 0,55 моль/л,
[I2] = (2 - 0,45) = 1,55 моль/л,
[HI] = 2∙0,45 = 0,9 моль/л.
Пример 2. При некоторой температуре в системе 2NO2 (г)
2NO (г) + О2(г); равновесная концентрация О2 становится равной 0,2 моль/л, а Кp = 12,8. Определите начальную концентрацию реагента.
Решение. 2NO2 (г) 2NO (г) + О2(г);
ni, моль по уравн. 2 2 1
С0, моль/л ? 0 0
[ ], моль/л ? 2[О2] 0,2
Со,(N02) = [NO2] + ∆СNO2; ∆CN02= ∆CNO; ∆CNO= [NO] = 2[O2]

