
- •Введение
- •1. Общие указания по выполнению расчетно-графической работы
- •2. Правила составления уравнения реакции горения
- •3. Пример решения задач
- •Задачи для самостоятельного решения
- •Список рекомендуемой литературы
- •1. Оформление списка нормативно-правовых актов
- •2. Правила оформления списка научной литературы
- •Теплота образования () веществ при температуре 298,15 к
- •Периодическая система элементов д.И. Менделеева
- •Ивановский институт Государственной противопожарной службы мчс России
- •Теория горения и взрыва
- •153040, Г.Иваново, пр.Строителей, 33
3. Пример решения задач
Задача. Используя данные таблицы, определить показатели пожарной опасности толуола: группу горючести, температуру вспышки; концентрационные пределы распространения пламени (в % и г/м3) при t = 25, 45 и 65 oC, построить график зависимости КПР от температуры; температурные пределы распространения пламени, низшую теплоту сгорания по следствию из закона Гесса; максимальное давление взрыва, тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании. Рассчитать объем воздуха, объем и процентный состав компонентов продуктов горения.
|
Начальное давление, Па |
Начальная температура, 0С |
Температура взрыва, 0С. |
Масса вещества, кг |
Коэффициент избытка воздуха |
|
101 300 |
23 |
2678 |
10 |
1,3 |
Дано:
С7Н8
m = 10 кг;
α = 1,3;
Рн = 0,1 МПа;
tн = 23 0С;
tВЗР = 2678 0С.
Найти: группу горючести, tВСП., КПР, ТПР, QН, РВЗР, VВ, VПГ, φПГ.
Решение:
1. Составляем уравнение реакции горения толуола в воздухе (см. правила составления уравнения реакции горения) и определяем стехиометрический коэффициент β (коэффициент перед кислородом):
1C7Н8 + 9(О2 + 3,76 N2) → 7СО2 + 4Н2О + 9 ∙ 3,76 N2
β = 9
2. Рассчитываем объём, занимаемый 1 кмоль воздуха при заданных условиях.


3. Рассчитываем молярную массу толуола.
М (C7H8) = 12 7 + 1 8 = 92 кг/кмоль
4. Рассчитываем объём воздуха, необходимого для полного сгорания заданной массы толуола.


5. Определяем избыточное количество вещества кислорода и азота.
 =
(
- 1), кмоль;
=
(
- 1), кмоль;  =
9(1,3 - 1) = 2,7 кмоль
=
9(1,3 - 1) = 2,7 кмоль
 =3,76
(
- 1), кмоль;
=3,76
(
- 1), кмоль;  =3,76
9(1,3 - 1) = 10,2 кмоль
=3,76
9(1,3 - 1) = 10,2 кмоль
6. Рассчитываем общее количество вещества продуктов горения.
nпг
= ,
кмоль;
,
кмоль;
nпг = 7 + 4 + 33,84 + 2,7 + 10,2 = 57,74 кмоль
7. Определяем общий объём образующихся продуктов горения.
 ,
м3;
,
м3;

8. Определяем мольный процентный состав
компонентов продуктов горения. Принимаем
общее количество вещества продуктов
горения за 100%, а количество вещества
конкретного продукта реакции за
 %:
%:
Для СО2 получаем следующую пропорцию.
nпг = 57,74 кмоль – 100%
 =
7 кмоль –
=
7 кмоль –
 %,
%,
отсюда
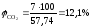
Аналогично находим процентное содержание оставшихся продуктов горения:

При расчете процентного содержания азота суммируем его количество перешедшее в продукты горения в результате реакции и из избытка воздуха.
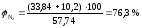
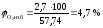
9. Определяем группу горючести толуола. Для этого рассчитываем его коэффициент горючести по формуле:
К = 4nC + 4nS + nH + nN - 2nO - 2nCl - 3nF - 5nBr
где: nC, nS, nH, nN, nO, nCl, nF, nBr- соответственно число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора, брома в молекуле вещества.
Если расчётное значение К 0 – вещество негорючее, 0 К 2 – вещество трудногорючее, К > 2 – вещество является горючим.
Записываем количество атомов составляющих толуол (С7Н8 ): nC= 7; nH= 8;
Рассчитываем коэффициент горючести:
К = 4nC + 4nS + nH + nN - 2nO -2nCl -3nF - 5nBr = 4 7 + 8 = 36
Вывод: К > 2, следовательно, толуол – горючее вещество.
10. Определяем температуру вспышки. Для этого по справочнику [4] находим температуру кипения толуола:
tкип = 110,6 0С.
Определяем температуру вспышки по формуле Элея:
 .
.
Справочное значение 7 0С [4].
11. Рассчитываем нижний и верхний концентрационный пределы распространения пламени толуола при стандартных условиях по формуле:
 ,
об. %
,
об. %
где
 -
нижний (верхний) концентрационные
пределы распространения пламени, % об.;
-
нижний (верхний) концентрационные
пределы распространения пламени, % об.;
- число молекул кислорода, необходимое для полного окисления молекулы горючего;
a и b - константы определяемые по табл. 2 приложения 2.
Концентрационные пределы распространения пламени при заданных условиях рассчитываются по формулам:


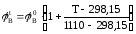
где
 и
и
 -
концентрационные пределы распространения
пламени при стандартной температуре
Тст.у.;
-
концентрационные пределы распространения
пламени при стандартной температуре
Тст.у.;
 и
и
 -
концентрационные пределы распространения
пламени при заданной температуре Т;
-
концентрационные пределы распространения
пламени при заданной температуре Т;
1550 К и 1110 К - температура горения соответственно на нижнем и верхнем концентрационных пределах распространения пламени.
Рассчитываем КПР при стандартной температуре.
Для
расчета
 выбираем из табл. 2 Приложения 2: a
= 8.64, b
= 4.679.
выбираем из табл. 2 Приложения 2: a
= 8.64, b
= 4.679.

Для
расчета
 при
> 7.5 a
= 0.768, b
= 6.554.
при
> 7.5 a
= 0.768, b
= 6.554.

Рассчитываем КПР при температуре Т = 273,15 + 45 = 318,15 К.


Рассчитываем КПР при температуре Т = 273,15 + 65 = 338,15 К.


Строим графики зависимостей КПР от температуры.

Из графика делаем вывод, что с увеличением температуры НКПР толуола незначительно уменьшается, ВКПР – сильно возрастает. Изменение ВКПР приблизительно в 10 раз превышает изменение НКПР. Таким образом, с ростом температуры область воспламенения паров толуола расширяется.
12. Рассчитываем концентрационные пределы распространения пламени толуола в граммах на кубометр (/н или /в):
 ,
г/м3
,
г/м3
где
Vt – объем занимаемый 1 кмоль газа при заданной температуре и давлении, м3/кмоль;
М – молярная масса, кг/кмоль.
Определяем мольный объем паров толуола при заданных температурах:
При Т
= 298.15 К


При Т
= 318.15 К


При Т
= 338.15 К


Рассчитываем КПР паров толуола при заданных температурах:
При Т
= 298.15 К
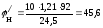 г/м3;
г/м3;
 г/м3
г/м3
При Т
= 318.15 К
 г/м3;
г/м3;
 г/м3
г/м3
При Т
= 338.15 К
 г/м3;
г/м3;
 г/м3
г/м3
13. Определяем температурные пределы распространения пламени по уравнению Антуана:
 ,
,
где
tН(В) – нижний (верхний) температурные пределы распространения пламени;
 -
давление насыщенного пара на нижнем
(верхнем) температурном пределе
распространения пламени, мм.рт.ст.;
-
давление насыщенного пара на нижнем
(верхнем) температурном пределе
распространения пламени, мм.рт.ст.;
А, В, С – константы, определяемые по таблице 10 Приложения 2.
Определяем давление насыщенного пара на нижнем и верхнем температурных пределах распространения пламени по формуле:



Из табл. 10 приложения 2 находим значения констант А, В и С для толуола:
А = 6,95508, В = 1345,087, С = 219,516
Подставляем значения в уравнение Антуана и определяем температурные пределы распространения пламени:


Справочные значения tн = 6 оС, tв = 37 оС [4].
14. Рассчитываем низшую теплоту сгорания толуола, используя следствие из закона Гесса.
Qн
= [(ni )ПГ
- (nj
)ПГ
- (nj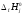 )ГВ],
кДж/моль.
)ГВ],
кДж/моль.
Здесь
niи
 - число молей и стандартные энтальпии
образования компонентов продуктов
горения (ПГ), nj
и
- число молей и стандартные энтальпии
образования компонентов продуктов
горения (ПГ), nj
и
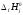 - число молей и стандартные энтальпии
образования компонентов горючей смеси
(ГВ).
- число молей и стандартные энтальпии
образования компонентов горючей смеси
(ГВ).
По уравнению реакции находим, что при сгорании 1 моль толуола выделяется 7 моль углекислого газа и 4 моль воды:
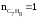 ,
,
 ,
,

Определяем по табл. 3 приложения 2 значения стандартных теплот образования горючего вещества и продуктов горения, учитывая при этом, что теплоты образования простых веществ (О2, N2) равны нулю.
f =
50,02 кДж/моль;
=
50,02 кДж/моль;
f =
-393,65 кДж/моль;
=
-393,65 кДж/моль;
f =
-241,91 кДж/моль
=
-241,91 кДж/моль
Следует иметь в виду, что существует две шкалы тепловых эффектов. В термодинамической шкале экзотермическому процессу соответствует знак минус, эндотермическому – знак плюс. В термохимической шкале знаки изменяются на противоположные. В справочной литературе используется в основном термодинамическая шкала. Однако для расчетов в курсе «Теории горения и взрыва» применяют термохимическую шкалу. Поэтому значения стандартных энтальпий образования веществ нужно подставлять в уравнение с обратным знаком.
Qн
= = 7393,65
+ 4241,91
– 1∙(-50,02) =
3773,21 кДж/моль.
= 7393,65
+ 4241,91
– 1∙(-50,02) =
3773,21 кДж/моль.
15. Рассчитываем максимальное давление взрыва паров толуола при заданных условиях по формуле:

где
Рн – давление паровоздушной смеси до взрыва, Па;
ТВЗР – температура взрыва, К;
Тн - температура паровоздушной смеси до взрыва, К;
nпг - число моль продуктов горения, моль;
ncм - число моль исходной газовоздушной смеси, моль.
По уравнению реакции горения определяем число моль газов в горючей смеси до взрыва и число моль продуктов горения.
ncм
=
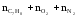 = 1 + 9 + 9∙3,76 = 43,84 моль
= 1 + 9 + 9∙3,76 = 43,84 моль
nп.г= = 7 + 4 + 33,84 + 2,7 + 10,2 = 57,74 моль
= 7 + 4 + 33,84 + 2,7 + 10,2 = 57,74 моль
Переводим начальную температуру и температуру взрыва из шкалы Цельсия в шкалу Кельвина:
Тн = 273 + 23 = 296 К
ТВЗР = 273 + 2678 = 2951 К
Рассчитываем давление взрыва паров толуола при заданных условиях.

16. Рассчитываем тротиловый эквивалент возможного аварийного взрыва паров толуола при взрыве в технологическом оборудовании по формуле:
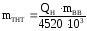
где
QН - низшая теплота сгорания взрывчатого вещества, Дж/кг;
mВВ – масса горючего вещества в смеси, кг;
4520103 – низшая теплота сгорания тринитротолуола (ТНТ), Дж/кг.
Согласно расчету, проведенному в п.14, низшая теплота сгорания толуола равна Qн = 3773,21 кДж/моль. Переводим ее в кДж/кг, разделив на молярную массу (92∙10-3 кг/моль):

Рассчитываем тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании:
 кг
тротила
кг
тротила
Ответ: объем воздуха, необходимый для сгорания 10 кг толуола равен 147,1 м3, объем выделившихся в результате горения продуктов равен 152,5 м3, процентное содержание углекислого газа равно 12,1%, воды – 6,9%, азота – 76,3%, избыточного кислорода – 4,7%; температура вспышки толуола равна 30С; КПР при стандартной температуре составляют 1,21 – 7,43 об.%, 45,6 – 279,4 г/м3, при температуре 45 0С область воспламенения составит 1,19 – 7,61 об.%, 42,1 – 268,3 г/м3, при температуре 65 0С область воспламенения составит 1,17 – 7,79 об.%, 39,0 – 258,5 г/м3. Таким образом, с увеличением температуры НКПР толуола незначительно уменьшается, ВКПР – сильно возрастает. Изменение ВКПР приблизительно в 10 раз превышает изменение НКПР. Температурные пределы распространения пламени равны 5 – 39 0С; низшая теплота сгорания равна 3773,21 кДж/моль; максимальное давление при взрыве равно 1330127,2 Па; тротиловый эквивалент возможного аварийного взрыва паров толуола при взрыве в технологическом оборудовании составит 90,7 кг.
