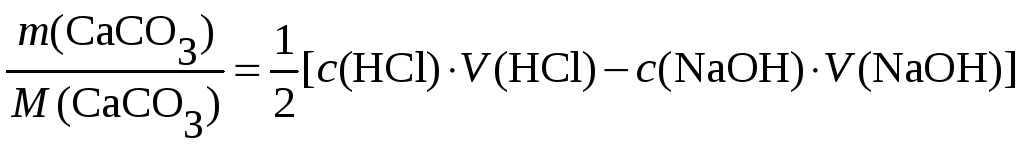Лек 1Т 02.04.09
.docКалинкин И.П., Маметнабиев Т.Э.
Титриметрические методы анализа (сокращенно ТА).
Вводная лекция (Файл 1Т 02.04.09)
1. Введение в титриметрические методы анализа. Сущность и техника титриметрического анализа. Точка эквивалентности (ТЭ) (точка стехиометричности ТС). Кривая титрования как основа выбора и обоснования условий титрования. Конечная точка титрования (КТТ) и способы регистрации КТТ.
2. Классификация титриметрических методов анализа (по типам реакций титрования, по технике титрования). Общие принципы количественных расчетов при прямом, обратном титрованиях и титровании заместителя.
Количественные определения, осуществляемые титрованием, объединяются под общим названием титриметрический анализ или сокращенно — титриметрия.
Титриметрический анализ основан на точном измерении количества реагента T, затраченного на реакцию с определяемым веществом А в ходе титрования
Титрование – это процесс постепенного добавления небольшими порциями стандартного (рабочего) раствора реагента к раствору определяемого компонента или вещества. В настоящее время определяемые компоненты, вещества, ионы, молекулы называют аналитами.
Стандартный или рабочий раствор – это раствор с точно известной концентрацией химически активного вещества (реагента ). Стандартный (рабочий) раствор, который используется при проведении титрования, называется титрантом, который в разных источниках обозначается разными символами: Т или В или R. Мы будем пользоваться символом Т [2].
Существуют два способа введения титранта в исследуемый раствор. В классической варианте он подается механически небольшими порциями из стеклянной градуированной трубки – бюретки, которая позволяет тщательно измерить объем титранта, затраченный на титрование. Наряду с этим разработан более точный и перспективный метод кулонометрического титрования. В этом случае известное количество иона‑титранта генерируется (образуется) в процессе протекания электрохимической реакции на электроде, погруженном в анализируемый раствор. Образующийся титрант механически размешивается, реагируя с определяемым ионом.
В классическом титровании масса аналита рассчитывается исходя из концентрации и объема титранта, затраченного на титрование. При добавлении каждой порции титранта в титруемом растворе протекает химическая реакция между аналитом и введенным в раствор реагентом, содержащимся в титранте, и в системе устанавливается равновесие.
Эту реакцию называют реакцией титрования, ее уравнение можно записать в общем виде:
aА
+ tT
![]() продукты реакции.
(1)
продукты реакции.
(1)
где А − аналит (определяемое вещество или компонент), Т – титрант, a, t − стехиометрические коэффициенты.
Титрование продолжают до тех пор, пока не будет достигнуто стехиометрическое соотношение между количеством аналита n(А) и количеством титранта. n(Т). Точка при титровании, в которой количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой стехиометричности (ТС) или точкой эквивалентности (ТЭ).
Если реакция титрования описывается уравнением (1), то в точке эквивалентности (ТЭ) [точке стехиометричности (ТС)] количества стехиометрично прореагировавших веществ А и T относятся как их стехиометрические коэффициенты в уравнении реакции (1):
![]() ( 2 )
( 2 )
Следовательно, условием материального баланса является равенство:
![]() (
2'
)
(
2'
)
откуда
![]() (
2''
)
(
2''
)
Здесь n(A) и n(T) — соответственно количества аналита A и титранта T, измеряемые
в молях или ммолях.
Обычно по результатам титрования вычисляют массу аналита m(A) в граммах. Раскрывая обе части уравнения (2’), с учетом совместимости единиц измерения, получаем:
![]()
откуда
![]() (3),
(3),
где
![]() - молярная концентрация титранта,
- молярная концентрация титранта,
![]() - объем титранта, пошедший на титрование
в литрах,
- объем титранта, пошедший на титрование
в литрах,
![]() - молярная масса аналита.
- молярная масса аналита.
Переводной множитель 10–3 в уравнении (3) опускается в тех случаях, когда массу m(A) рассчитывают в мг, объем V(T) берут в мл.
На практике во многих случаях расчет результатов титриметрических определений удобнее проводить на основе принципа эквивалентности. При этом стехиометрию кислотно-основных и окислительно-восстановительных реакций выражают в эквивалентной форме, а эталоном химического взаимодействия служит ион водорода или электрон. Все расчеты ведутся через количество молей или ммолей эквивалентов вещества, молярную массу эквивалента и молярную концентрацию эквивалента (нормальную концентрацию).
Согласно принципу эквивалентности, в любом титровании в точке эквивалентности количество молей (ммолей) эквивалентов стандарта (титранта) точно равно количеству молей (ммолей) эквивалентов реагирующего с ним аналита (вещества реагируют между собой в эквивалентных количествах).
Следовательно, количества молей(миллимолей) эквивалентов аналита A :
![]() и титранта T:
-
и титранта T:
-
![]() ,
участвующих в реакции (1), в точке
эквивалентности будут равны и для
уравнения (1) можно записать:
,
участвующих в реакции (1), в точке
эквивалентности будут равны и для
уравнения (1) можно записать:
![]() ,
(3)
,
(3)
где в общем случае
для любого вещества Х:
![]() -фактор
эквивалентности вещества Х;
-фактор
эквивалентности вещества Х;
![]() -эквивалент
вещества Х и
-эквивалент
вещества Х и
![]() —
аббревиатура количества молей или
ммолей эквивалентов вещества Х. Под Х
можно подразумевать и аналит А и титрант
Т.
—
аббревиатура количества молей или
ммолей эквивалентов вещества Х. Под Х
можно подразумевать и аналит А и титрант
Т.
Фактор
эквивавлентности
![]() это число, обозначающее какая доля
реальной частицы вещества Х
эквивалентна одному иону водорода в
данной кислотно-основной реакции или
одному электрону в данной окислительно
- восстановительной реакции
это число, обозначающее какая доля
реальной частицы вещества Х
эквивалентна одному иону водорода в
данной кислотно-основной реакции или
одному электрону в данной окислительно
- восстановительной реакции
Эквивалентом
![]() любого
вещества Х в общем случае называют
такую реальную или условную
частицу, которая в данной
реакции будет эквивалентна одному иону
водорода в кислотно‑основных реакциях
или одному электрону в окислительно ‑
восстановительных реакциях.
любого
вещества Х в общем случае называют
такую реальную или условную
частицу, которая в данной
реакции будет эквивалентна одному иону
водорода в кислотно‑основных реакциях
или одному электрону в окислительно ‑
восстановительных реакциях.
Химический эквивалент вещества не постоянен, он определяется типом химической реакции и конкретной реакцией.
Так, в реакциях кислотно ‑ όсновного взаимодействия эквивалентом называют такую реальную или условную частицу, на которую приходится один принимаемый или отдаваемый ион водорода в данной реакции, например:
Na2CO3 + HCl
= NaHCO3 + NaCl:
![]() ,
а эквивалент
– Na2CO3;
,
а эквивалент
– Na2CO3;
Na2CO3 + 2HCl = 2NaCl + H2СО3:![]() ,а
эквивалент ½
Na2CO3;
,а
эквивалент ½
Na2CO3;
H3PO4 + NaOH = NaH2PO4 + H2O:
![]() ,
а эквивалент
– H3PO4;
,
а эквивалент
– H3PO4;
H3PO4 + 2NaOH = Na2HPO4 + 2H2O:
![]() ,
а эквивалент
– ½
H3PO4;
,
а эквивалент
– ½
H3PO4;
В реакциях окисления‑восстановления эквивалентом называют такую условную частицу, на которую приходится один отдаваемый или принимаемый электрон в данной реакции. Например:
5H2C2O4 + 2KMnO4 + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O + 10CO2↑
![]() ,а
эквивалент – ½H2C2O4 и
,а
эквивалент – ½H2C2O4 и
![]() ,а
эквивалент - 1/5KMnO4.
,а
эквивалент - 1/5KMnO4.
Для расчетов массы аналита левую часть уравнения (3) раскрывают как
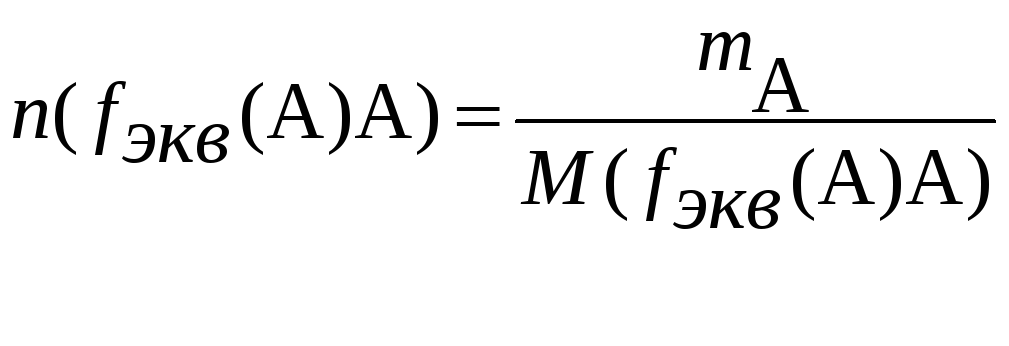
а правую как
![]() ,
,
где
![]() - молярная концентрация эквивалента
(нормальная концентрация) титранта, а
- молярная концентрация эквивалента
(нормальная концентрация) титранта, а
![]() - молярная масса эквивалента аналита.
- молярная масса эквивалента аналита.
Подставляя приведенные соотношения в уравнение (3) с учетом совместимости единиц измерений, получаем m(A) в г:
![]() (4)
(4)
Переводной множитель 10–3 в уравнении (4) опускается в тех случаях, когда массу m(A) рассчитывают в мг, объем V(T) берут в мл.
1.2 Кривые титрования. Конечная точка титрования (КТТ) и способы еe регистрации
В процессе титрования изменяются равновесные концентрации аналита (определяемого компонента или вещества), титранта и продуктов реакции. При этом пропорционально концентрациям этих веществ изменяются свойства раствора. Например, при окислительно-восстановительном титровании изменяются равновесные концентрации окислителя и восстановителя и, следовательно, потенциал; при изменении концентраций компонентов кислотно-основной реакции изменяется pH раствора. График зависимости регистрируемого параметра системы, связанного с концентрацией титруемого аналита или титранта, или продукта, от состава раствора в процессе титрования называют кривой титрования.
Кривые титрования помогают выбрать индикатор, оценить погрешность, наглядно проследить за ходом титрования. При построении таких кривых по осям координат можно откладывать разные величины. Если по оси ординат отложить логарифм концентрации или величину, пропорциональную этому логарифму, получают монологарифмическую кривую титрования (рис.2.2).
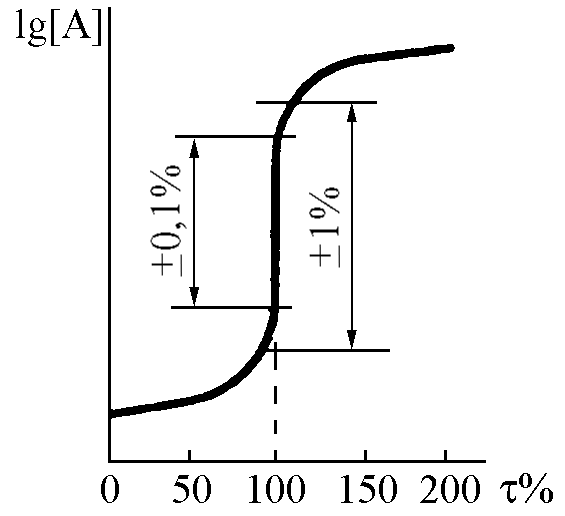
Рисунок 2.2 ─ Монологарифмическая кривая титрования
На оси абсцисс можно откладывать объем добавленного титранта (раствора реагента) V(T). Однако для проведения математического анализа кривых титрования более удобно на оси абсцисс откладывать степень оттитрованности τ.
Степень
оттитрованности τ ─ это отношение
количества
![]() добавленного
в данный момент титранта Т к исходному
количеству
добавленного
в данный момент титранта Т к исходному
количеству
![]() аналита А. Поскольку
аналита А. Поскольку
![]() и
и
![]() ,
получают:
,
получают:
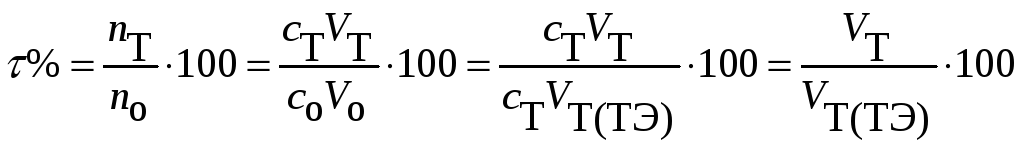
При
![]()
![]() ,
,
где
![]() ─ объем титранта, добавленный к данному
моменту титрования;
─ объем титранта, добавленный к данному
моменту титрования;
![]() ─ исходный объем аналита;
─ исходный объем аналита;
![]() ─ объем титранта, добавленный к моменту
эквивалентности;
─ объем титранта, добавленный к моменту
эквивалентности;
![]() и
и
![]() ─ молярные концентрации эквивалентов
(нормальные концентрации) аналита и
титранта.
─ молярные концентрации эквивалентов
(нормальные концентрации) аналита и
титранта.
Степень
оттитрованности выражают либо в %, либо
в долях. В последнем случае
![]() нередко
называют титровальной долей. До точки
стехиометричности
нередко
называют титровальной долей. До точки
стехиометричности
![]() <
100% (<1 в
долях), в точке
стехиометричности
<
100% (<1 в
долях), в точке
стехиометричности
![]() =
100%) (=1 в долях)
и после точки стехиометричности t
> 100% (>1 в
долях).
=
100%) (=1 в долях)
и после точки стехиометричности t
> 100% (>1 в
долях).
На логарифмических кривых титрования ТЭ соответствует точке перегиба кривой титрования.
Как видно из рисунка, логарифмическая кривая титрования имеет две пологие ветви, между которыми находится крутой участок, называемый скачком титрования. Величина скачка титрования определяется значением константы равновесия реакции титрования, концентрациями титранта и тируемого вещества (аналита), а также выбором точки начала и точки конца скачка титрования.
Если полнота протекания реакции обеспечена не менее чем на 99,9%, то выбор этих точек определяется значением допустимой систематической погрешности при данном титриметрическом определении.
Если допускаемая
систематическая относительная погрешность
измерения объема титранта, пошедшего
на титрование
![]() ,
равна 0,1%, то считают, что точка начала
скачка титрования соответствует t
= 99,9% (недотитровано 0,1% определяемого
вещества). Точка конца скачка титрования
в этом случае соответствует t
= 100,1%, т.е. добавлено 0,1% избытка реагента
от стехиометрического количества
(рис.). Тогда скачок титрования соответствует
диапазону t
= 99,9 –100,1%.
,
равна 0,1%, то считают, что точка начала
скачка титрования соответствует t
= 99,9% (недотитровано 0,1% определяемого
вещества). Точка конца скачка титрования
в этом случае соответствует t
= 100,1%, т.е. добавлено 0,1% избытка реагента
от стехиометрического количества
(рис.). Тогда скачок титрования соответствует
диапазону t
= 99,9 –100,1%.
При более грубых
определениях (измерениях объемах
титранта) допускают относительную
погрешность
![]() ,
и тем самым величина скачка титрования
возрастает. В этом случае скачок
титрования соответствует диапазону t
= 99 – 101%.
,
и тем самым величина скачка титрования
возрастает. В этом случае скачок
титрования соответствует диапазону t
= 99 – 101%.
Чтобы при титровании погрешность не превышала заданного значения, титрование надо прекратить в пределах скачка титрования. Другими словами, КТТ — точка кривой титрования, при которой прекращается титрование, должна находиться в пределах скачка титрования.
Момент окончания титрования (КТТ) можно установить при помощи химической реакции или по изменению некоторого физико-химического свойства раствора. В классических вариантах титриметрии чаще всего используют индикаторы — органические красители.
Индикаторами называют вещества, которые при изменении концентрации аналита или титранта изменяют свою окраску, степень люминесценции или образуют осадок в ТЭ или вблизи нее. Присутствуя в достаточно малых концентрациях, они не требуют ощутимого количества титранта в процессе титрования.
Если проба или титрант сами по себе окрашены, специальный индикатор может не потребоваться. Цветные индикаторы должны сами проявлять свойства, положенные в основу соответствующей титриметрической реакции, т.е. представлять собой в зависимости от конкретного метода кислотно - όсновную либо окислительно-восстановительную пару, быть хелатообразующим лигандом и т.п.
Различают следующие типы визуальных индикаторов: одноцветные или двухцветные; кислотно - όсновные, адсорбционные, хемилюминесцентные, экстракционные, флуоресцентные, металлохромные, металлофлуоресцентные, смешанные, окислительно-восстановительные, осадительные. Индикаторы характеризуются интервалом перехода окраски индикатора, т.е. минимальный интервалом концентрации ионов водорода ( в кислотно-όсновном титровании) или окислительно-восстановительного потенциала
( при окислительно-восстановительном титровании), при котором наблюдается переходная ( смешанная) окраска двухцветных индикаторов.
Для нахождения КТТ следует выбирать такой индикатор, который дает сигнал (изменение цвета, степени люминесценции, появление осадка и т.д.) в пределах скачка титрования. КТТ и ТЭ обычно несколько не совпадают, что обусловливает систематическую погрешность; в случае применения индикатора ее называют индикаторной погрешностью (ошибкой). Индикаторная погрешность в зависимости от правильности выбранного индикатора может колебаться в диапазоне от сотых до нескольких процентов. В общем случае интервал перехода окраски индикатора должен находиться в пределах скачка титрования и как можно ближе к ТЭ кривой титрования, а в оптимальном варианте — перекрывать ТЭ. Методики и формулы расчета индикаторных погрешностей при кислотно-основном, комплексонометрическом и окислительно-восстановительном титровании представлены, например, в [ 2 - 4, 8 ].
При визуальной регистрации добавление реагента прекращают, достигнув конечной точки титрования. При инструментальной регистрации титрант обычно добавляют и после конечной точки титрования (примерно до двойного стехиометрического количества), определяя затем КТТ графически из кривой титрования.
2. Классификация титриметрических методов анализа
2.1 Классификация титриметрических методов по типам реакций титрования
Титриметрические методы классифицируются по реакциям титрования. Они могут быть реакциями перехода протонов, обмена электронами, образования малодиссоциированных (комплексных) частиц или образования малорастворимых электролитов. Соответствующие группы титриметрических методов называют кислотно-основным титрованием (протолитометрией), окислительно-восста-новительным титрованием (редоксметрией), комплексометрическим титрованием (комплексометрией) и осадительным титрованием (седиметрией). Отдельные титриметрические методы называются по реагентам, применяемым в этих методах (табл.)
Таблица - Классификация титриметрических методов по типам реакций титрования
[ 2 – Ю.А.Золотов кн 2 с.32.]
(комплексон III — двунатриевая соль этилендиаминтетрауксусной кислоты –
Na2H2Y∙2H2O, где Y — символ аниона этилендиаминтетрауксусной кислоты).
|
Метод титровния, тип реакции |
Подгруппы методов |
Отдельные методы |
Вещества, применямые для приготовления титрантов |
Вещества, определяемые прямым титрованием |
|
Кислотно-όсновное титрование, протолитометрия H3O+ +OH– =2H2O |
Ацидиметрия |
|
HCl, H2SO4 |
Основания |
|
Алкалиметрия |
NaOH |
Кислоты |
||
|
Окислительно – восстановительное титрование, редоксметрия aOx1 + bRed2 = =aRed1 + bOx2 |
Оксидиметрия |
Перманганатометрия |
KMnO4 |
Восстановители |
|
Иодометрия |
I2 |
То же |
||
|
Дихроматометрия |
K2Cr2O7 |
То же |
||
|
Броматометрия |
KBrO3 |
То же |
||
|
Иодатометрия |
KIO3 |
То же |
||
|
Цериметрия |
Ce(SO4)2 |
То же |
||
|
Ванадатометрия |
NH4VO3 |
То же |
||
|
Редуциметрия |
Титанометрия |
TiCl3 |
Окислители |
|
|
Хромометрия |
CrCl2 |
То же |
||
|
Аскорбинометрия |
|
То же |
||
|
Комплексометрическое титрование, комплексометрия M + L = ML |
|
Меркуриметрия |
Hg(NO3)2 |
Галогениды и псевдогалогениды |
|
Цианидометрия |
KCN |
Ионы никеля(II), кобальта(II), алюминия, циркония(IV) и тория(IV) |
||
|
Хелатометрия |
Комплексонометрия |
Комплексон III |
Ионы металлов |
|
|
Осадительное титрование, седиметрия M + X = MX(тв.) |
|
Аргентометрия |
AgNO3 |
Галогениды и псевдогалогениды |
|
Меркурометрия |
Hg2(NO3)2 |
Хлориды |
2.2. Классификация по способам титрования и принципы количественных расчетов.
Различают три способа титрования: прямое, обратное и титрование заместителя. Второй и третий применяют, когда не выполняется одно из требований, предъявляемых к реакции прямого титрования.
Прямое титрование — наиболее простой и точный способ, когда анализируемый раствор непосредственно титруют стандартным раствором. Здесь могут быть использованы разные типы реакций, если они удовлетворяют следующим требованиям:
1. Взаимодействие титруемого вещества со стандартным раствором должно быть стехиометричным и специфическим. Побочные реакции посторонних веществ, находящихся в анализируемом растворе, с титрантом и с титруемым компонентом должны быть исключены или их влияние должно быть ничтожным.
2. Реакция
титрования должна протекать количественно
(![]() ).
Это означает, что константа равновесия
реакции титрования должна быть достаточно
большой
).
Это означает, что константа равновесия
реакции титрования должна быть достаточно
большой
![]() 108.
108.
3. Реакция должна протекать быстро, состояние равновесия после добавления очередной порции титранта должно достигаться практически мгновенно, чтобы можно было проследить за процессом титрования.
4. Имеется подходящий индикатор, позволяющий четко фиксировать конец титрования.
Для реакции титрования общего вида (2.1) результат обычно вычисляют по уравнению (2.5) или (2.9) или по другим уравнениям табл.2.2 в зависимости от поставленной задачи
Обратное титрование ─ титрование избытка стандартного раствора, добавленного к анализируемому раствору. Его называют также титрованием остатка или титрованием по остатку. Обратное титрование обычно применяют в случае малой скорости прямой реакции или, когда отсутствует подходящий индикатор, или если определяемое вещество летучее.
При обратном титровании к раствору аналита или к анализируемому веществу добавляют точно известный избыточный объём первого стандартного раствора (т.е. известное количество первого реагента). Если реакция протекает медленно, её ускоряют нагреванием. По завершении реакции остаток (реагента) первого стандартного раствора титруют вторым стандартным раствором.
Пример 1. Определить содержание карбоната кальция в образце известняка кислотно - оснόвным титрованием. CaCO3 малорастворим в воде, а гетерогенная реакция его с разбавленным раствором кислоты протекает очень медленно. Прямое титрование невозможно.
Поэтому к анализируемому веществу добавляют точный объём стандартного раствора хлороводородной кислоты в заведомом избытке (точно известное количество HCl).
Раствор нагревают и ждут завершения реакции
CaCO3+ 2HCl(избыток)= CaCl2 + H2O + CO2,
в ходе которой
расходуется часть кислоты:
![]() .
Оставшуюся часть HCl (остаток)
.
Оставшуюся часть HCl (остаток)
![]() титруют стандартным раствором NaOH:в
присутствии индикатора:
титруют стандартным раствором NaOH:в
присутствии индикатора:
NaOH
+ HCl (остаток) = NaCl
+ H2O;
![]() .
.
Количество NaOH известно по результатам титровния:
![]()
Исходя из стехиометрии первой реакции и стехиометрии второй реакции, для точки эквивалентности можно записать:
![]() ,
,
где
![]() -
исходное количество HCl. Решим уравнение
относительно определяемой величины:
-
исходное количество HCl. Решим уравнение
относительно определяемой величины:
![]() .
.
Откуда: