
- •Елизарова е.П.
- •Электродный потенциал
- •1). Электроды первого рода
- •2).Электроды второго рода
- •Хлорсеребряный электрод
- •3). Окислительно-восстановительные.
- •Расчет электродных потенциалов Уравнение Нернста
- •Активность
- •Зависимость электродного потенциала от концентрации. Метод прямой потенциометрии
- •Измерение электродных потенциалов
1). Электроды первого рода
Металлический электрод погружен в раствор соли, содержащий катионы этого металла.
Пример:
Условная запись:
Zn/Zn2+ - цинковый электрод
(/) – граница раздела фаз;
окислительно-восстановительная реакция:
Zn0
![]() Zn2+
+ 2ē.
Zn2+
+ 2ē.
2).Электроды второго рода
Металл, покрытый малорастворимой солью этого металла, погружен в раствор, содержащий анион этой соли.
Пример:
Хлорсеребряный электрод
Условная запись:
Ag,AgCl/ KCl (Cl-);
Окислительно-восстановительная реакция:
AgCl
+ ē
![]() Ag0
+Cl-
Ag0
+Cl-
Второе название у этих электродов – электроды сравнения. При определенных внешних условиях они имеют определенное значение электродного потенциала.
Хлорсеребряный электрод при 20°С имеет значение 0,201 В при заполнении его насыщенным раствором хлорида калия.
3). Окислительно-восстановительные.
На инертном электроде протекает окислительно-восстановительная реакция в растворе.
Пример:
Железный электрод
Условная запись:
(Fe 2+ , Fe 3+ ) Pt;
Окислительно-восстановительная реакция:
Fe 2+ - ē → Fe 3+
Расчет электродных потенциалов Уравнение Нернста
В общем виде:
![]() =
= ![]() +
+ 
![]() -
стандартный электродный потенциал.
-
стандартный электродный потенциал.
Потенциал электрода, измеренный при стандартных условиях, относительно стандартного водородного электрода, потенциал которого равен нулю.
Справочная величина.
![]() –
газовая постоянная, равная 8,314 Дж/моль·К.
–
газовая постоянная, равная 8,314 Дж/моль·К.
![]() –
температура, К;
–
температура, К;
![]() –
число
электронов, участвующих в реакции;
–
число
электронов, участвующих в реакции;
![]() –
постоянная Фарадея, равная 96485 Кл/моль-экв.;
–
постоянная Фарадея, равная 96485 Кл/моль-экв.;
а – активность, моль/л.
Активность
Степень отклонения системы от идеального состояния может быть охарактеризовано коэффициентом активности, определяем как отношение активности к концентрации.

Коэффициенты активности безразмерны. В идеальных системах коэффициенты активности равны единице. Степень отклонения системы от идеального состояния характеризуется отклонением коэффициента активности от единицы.
Для разбавленного раствора коэффициент активности стремится к единице, следовательно, активность будет примерно равна концентрации.
Для идеальных или разбавленных растворов уравнение Нернста имеет вид:
![]() =
= ![]() +
+ 
Примеры:
Использование уравнения Нернста для электрода первого рода
( цинковый электрод).
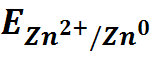 =
=  +
+ 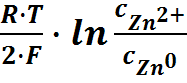 =
=
 +
+ 
Использование уравнения Нернста для электрода второго рода
( хлорсеребряный электрод).
 =
= ![]() -
- 
Использование уравнения Нернста для окислительно-восстановительного электрода
( железный электрод).
 =
=  +
+ 
Таким образом, величина электродного потенциала определяется:
-
Природой вещества;
-
Температурой;
-
Концентрацией электролита.
Зависимость электродного потенциала от концентрации. Метод прямой потенциометрии
Прямая потенциометрия – метод, позволяющий определить концентрацию вещества в электролите по величине потенциала электрода в растворе известного качественного состава. Прямая потенциометрия основана на измерении ЭДС (электродвижущей силы) электрохимической цепи, составленной из исследуемого электрода и электрода сравнения, соединенных между собой при помощи солевого мостика.
Как следует из уравнения Нернста, электродный потенциал цинкового электрода зависит от концентрации ионов цинка в растворе. В координатах Е – lnC эта зависимость представляет собой прямую линию.

Рис.4.
Зависимость электродного потенциала от концентрации.
