
- •Херсонский национальный технический университет к афедра экологии и бжд
- •Цель работы
- •2. Теоретическая часть
- •Электрические эквиваленты некоторых ионов
- •2.2. Вычисления в электрохимических процессах
- •Экспериментальная часть
- •3.1. Описание экспериментальной установки
- •3.2. Порядок проведения работы
- •4. Составление отчета
- •5. Контрольные вопросы
- •6. Техника безопасности
- •7. Материальное обеспечение
- •Варианты для выполнения работы
2.2. Вычисления в электрохимических процессах
Время
покрытия -
![]() ,
(11)
,
(11)
Толщина покрытия –
![]() ,
(12)
,
(12)
где δ - толщина покрытия, мм;
γ - плотность осаждаемого металла, г/см3;
Дк - катодная плотность тока, А/дм2;
Е - электрохимический эквивалент электролита, г/А·ч;
η - выход по току, %.
-
Экспериментальная часть
3.1. Описание экспериментальной установки
Процесс электрохимического покрытия проводим на установке, схема которой показана на рисунке.

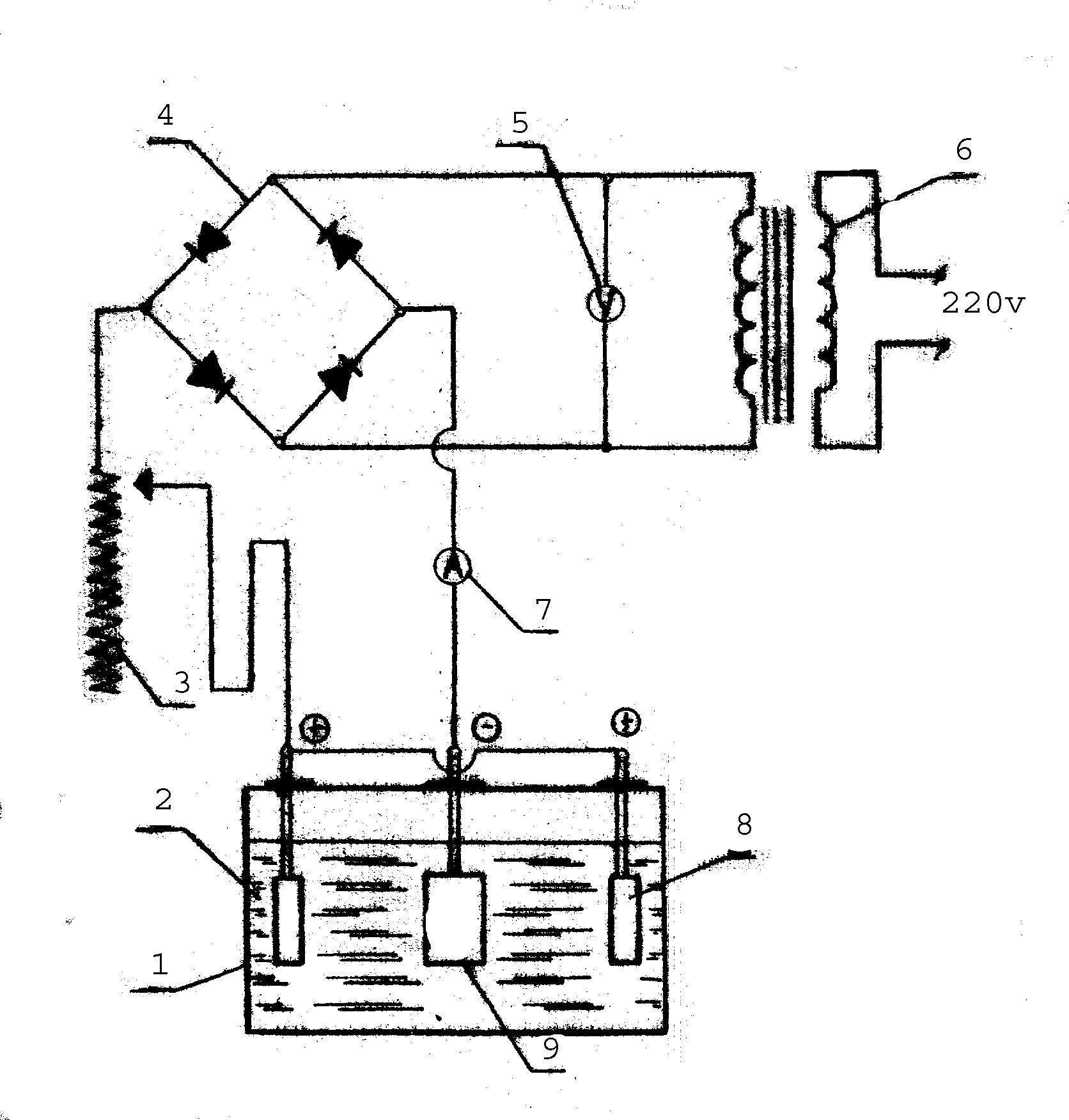
рис.1
Установка состоит из электролитической ванны 1, в которую залит электролит 2. В электролит погружены три электрода. Два из них - никелевые 8 (аноды), подключенные к положительному полюсу выпрямителя 4, третий 9 (катод), подключаемый к отрицательному полюсу выпрямителя, служащий для закрепления покрываемого изделия. В электрической цепи установлены реостат 3, вольтметр 5 и амперметр 7, служащие для измерения электрических характеристик процесса электролиза. Трансформатор 6 - для преобразования (понижения) напряжения.
3.2. Порядок проведения работы
Лабораторная работа проводится в такой последовательности:
1. Проверить исправность установки и ознакомиться с инструкцией по технике безопасности по рабочему месту.
2. Изучить и законспектировать основные положения данной работы.
3. Ответить на контрольные вопросы.
4. Ознакомиться с устройством и принципом работы установки и получить вариант задания у преподавателя.
5. Подготовить изделие для электрохимического покрытия для чего:
-измерить площадь покрываемого изделия, дм2;
-тщательно обработать изделие наждачной бумагой (сначала крупной, затем мелкой);
-обезжирить изделие, промыв его а растворе Na2CO3;
-промыть изделие дистиллированной водой;
-просушить и взвесить изделие на аналитических весах с точностью до третьего знака.
6. Включить установку в розетку.
7. С помощью трансформатора установить заданное напряжение.
8. Закрепить покрываемое изделие на аноде, опустить в электролит и заметить время начала электролиза.
9. С помощью реостата установить силу тока, рассчитанную по уравнению
I =Дк ∙F,
где Дк- катодная плотность тока. А/дм2;
F - площадь покрываемого изделия, дм2.
10. По истечении заданного времени электролиза вынуть изделие из ванны, промыть дистиллированной водой, высушить и снова взвесить на тех же весах.
11. По разности весов определить фактическое количество металла, осажденного на изделии
![]() ,
,
где
![]() -
масса образца покрытия, г;
-
масса образца покрытия, г;
![]() - масса образца после покрытия, г.
- масса образца после покрытия, г.
12. На основании полученных данных произвести расчеты.
4. Составление отчета
Отчет составляют на основании проведенных экспериментов. При этом необходимо выполнить расчеты и заполнить табл. 3.
Таблица 3
Результаты расчетов и измерений
(вариант …)
|
№ п/п |
Наименование измерения или расчета |
Единица |
Результат |
|
1 |
2 |
3 |
4 |
|
1 |
Площадь изделия |
S дм2 |
|
|
2 |
Масса изделия до покрытия |
G1 г |
|
|
3 |
Масса изделия после покрытия |
G2 г |
|
|
4 |
Теоретическое напряжение |
Vτ B |
|
|
5 |
Фактическое напряжение |
Vφ B |
|
|
6 |
Катодная плотностъ тока |
Дк А/дм2 |
|
|
7 |
Сила тока а цепи |
J А |
|
|
8 |
Время электролиза |
τ ч |
|
|
9 |
Теоретическая масса металла, который должен осадиться на изделии согласно законам Фарадея |
Г |
|
|
10 |
Фактическая масса металла, который осадился на изделии |
Г |
|
|
11 |
Электрохимический эквивалент |
г/А·ч |
|
|
12 |
Выход по току |
% |
|
|
13 |
Теоретический расход электроэнергии |
кВт·ч/г |
|
|
14 |
Фактический расход электроэнергии |
кВт·ч/г |
|
|
15 |
Коэффициент использования электроэнергии |
% |
|
|
16 |
Толщина покрытия |
Мм |
|
