
- •Е.А.Зеляева Основы общей химии в задачах и упражнениях
- •Под редакцией д.Х.Н. Лилеева а.С.
- •Раздел I: Основные понятия и простейшие расчеты
- •Раздел II: Основные классы химических неорганических соединений Часть I: Формулы и названия
- •Часть II: Классификация, методы получения и свойства оксидов, оснований, кислот и солей
- •Контрольные задания I
- •Химические свойства оснований
- •Контрольные задания II
- •Сокращенный ряд напряжений металлов
- •Контрольные задания III
- •Контрольные задания IV
- •Проверочная работа
Часть II: Классификация, методы получения и свойства оксидов, оснований, кислот и солей
Оксиды
Оксиды по химическим свойствам подразделяются на солеобразующие и несолеобразующие, или безразличные.
К
солеобразующим оксидам относятся такие
оксиды, которые способны вступать в
реакции с кислотами или основаниями, а
некоторые - и с кислотами и с основаниями,
образуя соль. Безразличные оксиды не
взаимодействуют ни с кислотами, ни с
основаниями. К ним относятся ![]() ,
,
![]() ,
,
![]()
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные.
Основные оксиды – это оксиды, которым соответствуют основания.
Так,
например, оксиду натрия соответствует
основание ![]() ,
оксиду магния – основание
,
оксиду магния – основание ![]() .
.
Основные оксиды образуют одно – и двухвалентные металлы, из рассматриваемых в данной работе это: оксиды щелочных металлов (все металлы (I)А группы), оксиды щелочноземельных металлов (кальция, стронция и бария), оксиды марганца (II), ртути (II), магния.
Кислотные оксиды – это оксиды, которым соответствуют кислоты.
Например,
оксиду углерода (IV)
- ![]() – соответствует угольная кислота
– соответствует угольная кислота ![]() , оксиду фосфора (V)
–
, оксиду фосфора (V)
– ![]() – фосфорная
– фосфорная ![]() .
.
Кислотные
оксиды образуют неметаллы (![]() и
т.д.) и металлы с высшими валентностями,
например
и
т.д.) и металлы с высшими валентностями,
например ![]() ,
,
![]() и другие.
и другие.
Кислотные
оксиды иногда называют “ангидридами”
соответствующих кислот, например ![]() – фосфорный ангидрид,
– фосфорный ангидрид, ![]() – угольный,
– угольный, ![]() - марганцовый.
- марганцовый.
Степень
окисления элемента, образующего кислотный
оксид, равна степени окисления этого
элемента в соответствующей
кислородосодержащей кислоте: степень
окисления углерода в ![]() и
и ![]() равна +4, а степень окисления фосфора в
равна +4, а степень окисления фосфора в
![]() и
и ![]() равна +5.
равна +5.
Упражнение
Выписать все кислородосодержащие кислоты (табл.1) и соответствующие им кислотные оксиды.
Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды, проявляющие свойства как кислот, так и оснований.
Так,
оксид цинка ![]() – амфотерный оксид, ему соответствует
амфотерный гидроксид
– амфотерный оксид, ему соответствует
амфотерный гидроксид ![]() ,
оксид хрома (III)
-
,
оксид хрома (III)
- ![]() -
тоже амфотерен, ему соответствует
амфотерный гидроксид
-
тоже амфотерен, ему соответствует
амфотерный гидроксид ![]() .
Амфотерные оксиды проявляют свойства
как основных, так и кислотных оксидов.
.
Амфотерные оксиды проявляют свойства
как основных, так и кислотных оксидов.
Амфотерные
оксиды образуют многие металлы. В
пределах рассматриваемого материала
необходимо запомнить следующие амфотерные
оксиды: ![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Характер оксидов закономерно изменяется у элементов одного и того же периода. Например, свойства оксидов элементов третьего периода периодической системы Д.И. Менделеева (рассматриваются оксиды высшей валентности) с увеличением порядкового номера элемента изменяются от основных через амфотерный оксид к кислотным, т.е. ослабевают основные и усиливаются кислотные свойства оксидов.
![]() ,
,
![]() ;
;![]() ;
;![]() ;
;![]()
Основные Амфотерный Кислотные
Элементы
с переменной валентностью (степенью
окисления) способны образовывать
несколько оксидов. Если это оксиды
неметаллов, то либо все они относятся
к кислотным, либо среди них есть
безразличные. Например, ![]() ,
,
![]() – безразличные оксиды, а
– безразличные оксиды, а ![]() ,
(
,
(![]() ),
),
![]() - кислотные. Если оксиды образованы
металлами с переменной валентностью
(степенью окисления) , то характер этих
оксидов изменяется с изменением
валентности (степени окисления) металла.
Марганец образует ряд оксидов
- кислотные. Если оксиды образованы
металлами с переменной валентностью
(степенью окисления) , то характер этих
оксидов изменяется с изменением
валентности (степени окисления) металла.
Марганец образует ряд оксидов
![]() ,
, ![]() ,
, ![]() , (
, (![]() )
,
)
, ![]()
Первые
два оксида являются основными оксидами,
диоксид марганца ![]() – амфотерным, последние – кислотные
оксиды. Таким образом, с увеличением
валентности (степени окисления) ослабевают
основные и усиливаются кислотные
свойства оксидов.
– амфотерным, последние – кислотные
оксиды. Таким образом, с увеличением
валентности (степени окисления) ослабевают
основные и усиливаются кислотные
свойства оксидов.
Методы получения оксидов
-
Непосредственное взаимодействие элемента с кислородом
![]() +
+ ![]() =
= ![]()
2![]() +
+ ![]() =
= ![]()
4![]() + 3
+ 3![]() = 2
= 2 ![]()
-
Окисление кислородом сложных веществ
![]() + 2
+ 2![]() =
= ![]() + 2
+ 2![]()
2![]() + 3
+ 3![]() = 2
= 2![]() +
+ ![]()
-
Разложение кислот, гидроксидов и солей (карбонатов, нитратов)
![]()
![]()
![]()
![]()
Химические свойства оксидов
-
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей
![]() +
+ ![]() =
= ![]()
![]() +
+ ![]() =
= ![]()
-
Большинство кислотных оксидов реагирует с водой с образованием кислот
![]() +
+ ![]() = 2
= 2![]()
-
Основные оксиды взаимодействуют с кислотами, образуя соль и воду
![]() + 2
+ 2![]() =
=
![]() +
+ ![]()
-
Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду
![]() + 2
+ 2![]() =
= ![]() +
+ ![]()
-
Кислотные и основные оксиды способны реагировать между собой с образованием солей
![]() +
+ ![]() =
= ![]()
![]() +
+ ![]() =
= ![]()
-
Амфотерные оксиды взаимодействуют как с кислотами, так и с щелочами с образованием соли и воды. В реакциях с кислотами амфотерные оксиды (например
 ,
,
 )
проявляют свойства осноных оксидов.
Им соответствуют основания (
)
проявляют свойства осноных оксидов.
Им соответствуют основания ( ,
,
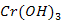 )
)
![]() + 2
+ 2![]() =
= ![]() +
+ ![]()
![]() + 3
+ 3![]() =
= ![]() + 3
+ 3![]()
В
реакциях сплавления с щелочами амфотерные
оксиды ведут себя как кислотные оксиды
(оксиду цинка соответствует цинковая
кислота ![]() ,
оксиду хрома – метахромистая кислота
,
оксиду хрома – метахромистая кислота
![]() )
)
![]() + 2
+ 2![]() =
= ![]() +
+ ![]()
![]() +
+ ![]() =
= ![]() +
+ ![]()
