
- •Допущено редакционно-издательским советом мгуиэ
- •Введение
- •Лабораторная работа № 1.
- •Лабораторная работа № 2. Скорость химической реакции
- •Лабораторная работа № 3. Приготовление растворов
- •Лабораторная работа № 4. Электролитическая диссоциация
- •Лабораторная работа № 5. Водородный показатель
- •Библиографический список
- •Оглавление
- •Лабораторные работы по общей химии
- •105066 Москва, Старая Басманная ул., 21/4
Лабораторная работа № 4. Электролитическая диссоциация
Электролитической диссоциацией называется процесс распада молекул вещества на ионы в растворе или расплаве.
Вещества, способные распадаться на ионы в растворе или расплаве, называются электролитами.
Основной количественной характеристикой процесса электролитической диссоциации является степень электролитической диссоциации ά (в дальнейшем — степень диссоциации), которая представляет собой отношение числа молекул, распавшихся на ионы Nрасп., к общему числу молекул электролита Nобщ.:
Электролиты подразделяются на сильные и слабые. Сильные электролиты практически полностью распадаются на ионы, слабые — диссоциируют частично.
Для обратимого процесса диссоциации слабого электролита в растворе можно записать константу равновесия, которая называется константой электролитической диссоциации Кдисс. (в дальнейшем — константой диссоциации).
Так, для диссоциации уксусной кислоты (CH3COOH), которая является слабым электролитом и диссоциирует согласно уравнению CH3COOH ↔ CH3COO- + H+.
Константа диссоциации Кдисс. равна отношению произведения молярных концентраций образовавшихся ионов [CH3COO-] и [H+] к молярной концентрации молекул уксусной кислоты [CH3COOH], оставшихся нераспавшимися к моменту установления равновесия
Кдисс. = ([CH3COO-] ∙ [H+])/[CH3COOH] (4.2)
Константа диссоциации является важной величиной, характеризующей способность к диссоциации слабых электролитов.
Между константой диссоциации Кдисс., степенью диссоциации ά и исходной молярной концентрацией слабого электролита в растворе С существует взаимосвязь, выражаемая законом разведения (или разбавления) Оствальда
Кдисс.
= С∙ά2/(1-
ά).![]() (4.3)
(4.3)
Если для слабых электролитов ά <<1, то величиной ά в знаменателе можно пренебречь по сравнению с единицей, и тогда уравнение (4.3) упрощается и имеет вид
Кдисс.
= С∙ά2![]() (4.4)
(4.4)
Следовательно, математическое выражение зависимости степени электролитической диссоциации от концентрации раствора слабого электролита имеет вид
ά =
![]()
![]() (4.5)
(4.5)
Растворы электролитов содержат заряженные частицы и поэтому проводят электрический ток. Изменение концентрации электролита влияет на количество ионов в растворе. Поэтому одним из основных методов изучения процесса электролитической диссоциации является метод, основанный на определении электропроводности растворов электролитов.
Электропроводностью (W) называется величина, обратная сопротивлению (R): W = 1/R (Ом-1) и, соответственно, удельной электропроводностью (χ) называется величина, обратная удельному сопротивлению (ρ): χ = 1/ ρ Ом-1см-1. Определение χ раствора сводится к измерению сопротивления раствора, находящегося между двумя металлическими пластинками датчика. Так как измеренное в опыте сопротивление зависит от размеров электродов , их формы, расстояния между ними и т.д., то для каждого датчика предварительно измеряется постоянная датчика k. Тогда удельную электропроводность раствора можно рассчитать по формуле
χ = k/Rx, (4.6)
где Rx — сопротивление раствора, измеренное с помощью данного датчика.
В электрохимии чаще пользуются не удельной, а эквивалентной электропроводностью λ.
λ = χ 1000/Сн (см2/Ом моль), (4.7)
где Сн — нормальная концентрация раствора.
Эквивалентная электропроводность равна электропроводности такого объема раствора, который содержит 1 моль эквивалентов электролита, помещенного между параллельными электродами, отстоящими на расстоянии 1 см друг от друга.
В очень разбавленных растворах (С→О) ионы находятся на большом расстоянии друг от друга и практически не испытывают взаимного влияния. Поэтому можно рассматривать движение каждого иона независимо от других. Тогда эквивалентная электропроводность бесконечно разбавленного раствора электролита λ0 будет равна сумме эквивалентных электропроводностей (подвижностей) катионов λ0+ и анионов λ0- (закон независимого движения Кольрауша)
λ 0 = λ0+ + λ0-. (4.8)
Так, для уксусной кислоты (CH3COOH) при 25ОС
λ0(H+) + λ 0(CH3COO-) = 349,8 + 40,9 = 390,7 (см2/Ом ∙ моль).
В растворах слабых электролитов конечной концентрации отношение эквивалентной электропроводности λ электролита при данной концентрации к эквивалентной электропроводности бесконечно разбавленного раствора λ0 равно степени диссоциации
ά = λ/λ0. (4.9)
-
Опыт. Определение степени и константы электролитической диссоциации уксусной кислоты
Степень и константу диссоциации растворов уксусной кислоты различной концентрации можно рассчитать, определив удельную и эквивалентную электропроводности растворов.
Определение электропроводности растворов является предметом метода, называемого кондуктометрией. Измеряемой величиной в этом методе является электросопротивление раствора электролита.
Измерение сопротивления раствора электролита
На рис. 4.1 изображена передняя панель универсального измерительного прибора Е7-13, с помощью которого можно измерить сопротивление растворов электролитов.
.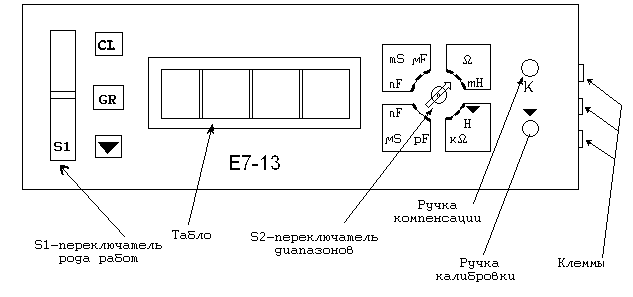
Рис. 4.1. Передняя панель прибора Е7-13
Порядок работы на приборе Е7-13
-
Включите прибор в сеть 220 в (тумблер на задней панели прибора).
-
Прогреть прибор в течение 10 минут.
-
Левый рычаг (переключатель S1) перевести в режим настройки (▼).
-
Переключатель диапазонов S2 перевести в режим настройки (▼).
-
Замкнуть крайние клеммы на правой боковой панели настроечным сопротивлением.
-
Ручкой компенсации К (правая верхняя ручка) довести показания прибора до 0.
-
Вынуть сопротивление.
-
Ручкой калибровки (▼) (правая нижняя ручка) отрегулировать показания прибора до 10.
-
Левый рычаг (переключатель S1) перевести в режим измерения (GR).
-
Подсоединить датчик к клеммам на правой панели.
-
Налить в стаканчик исследуемый раствор и опустить в него датчик. Электроды датчика должны быть погружены в раствор.
-
Измерить сопротивление раствора в диапазоне Ω (Омы), если измерение невозможно, перевести переключатель диапазонов S2 в положение кΩ (килоомы).
-
Поместить электроды в стаканчик с водой.
-
Отключить датчик, выключить прибор.
Примечание. Пункты с 1 по 7 выполняет лаборант перед началом занятий.
Экспериментальная часть
-
Приготовьте по 100 мл растворов уксусной кислоты с концентрациями, заданными преподавателем, из исходного концентрированного раствора. Для этого сначала рассчитайте, какой объем исходного раствора необходимо взять, чтобы при разбавлении его до 100 мл получился раствор нужной концентрации. Для расчета можно использовать следующую формулу V1 = 100 ∙ Cн(2) /Сн(1), (4.10) где Cн(2) и Сн(1) – нормальные концентрации исходного и заданного растворов, соответственно. С помощью бюретки введите в мерную колбу на 100 мл рассчитанный объем V1 исходного раствора, долейте воды до отметки и перемешайте полученный раствор.
-
Проведите измерение сопротивления заданных растворов. Для этого ополосните приготовленным раствором датчик и стаканчик, в котором производится измерение. Залейте в стаканчик свежую порцию раствора и опустите в него датчик. Количество раствора в стаканчике должно быть таким, чтобы электроды датчика были полностью погружены в него. Произведите измерение сопротивления раствора. Вылейте раствор из стаканчика, сполосните его и датчик раствором другой концентрации, налейте свежую порцию этого раствора и измерьте его сопротивление. По окончании всех измерений в стаканчик наливается вода.
-
Составьте таблицу по образцу
|
№ о п ы т а |
Норм. конц. раств.
Сэ |
Сопро- тивле- ние раств.
Rх |
Пос- тоян ная дат- чика k |
Уд. элект- ропро- вод.
χ |
Экви- вал. эл.- пров.
λ |
Пре дель- ная эл. пров, λ 0 |
Сте- пень дис- социа- ции λ |
Конст. диссо- циаии
Кдисс. |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
∙∙∙ |
|
|
|
|
|
|
|
|
Обработка и оформление полученных результатов
-
Рассчитайте для каждого раствора удельную электропроводность χ (уравнение 4.6), эквивалентную электропроводность λ (уравнение 4.7), степень диссоциации ά (уравнение 4.9), константу диссоциации Кдисс. (уравнение 4.4) и внесите полученные величины в таблицу.
-
Постройте на миллиметровой бумаге график зависимости степени диссоциации ά от нормальной концентрации раствора Сн.
-
Найдите среднее экспериментальное значение константы диссоциации уксусной кислоты Кдисс. ср.
-
Рассчитайте относительную ошибку опыта при определении константы диссоциации уксусной кислоты Кдисс. ср. по формуле e(%)=±[(Кдисс. теор.- Кдисн. ср.)/Кдисс. теор.] ∙ 100(%), (4.11) где Кдисс.. теор. – табличное значение константы диссоциации уксусной кислоты при 25ОС, равное 1,8 10-5.
