- •Лекция № 1 предмет органической химии
- •Теории химического строения
- •Основные положения теории бутлерова:
- •1. Положение о химическом строении.
- •2. Положение о зависимости свойств от химического строения.
- •3. Положение о взаимном влиянии атомов.
- •Классификация органических соединений
- •Электронные представления о природе химической связи
- •Электронная структура Схема основного электронного состояния
- •Образование ковалентной связи
- •Гибридизация электронов углерода. - и - связи.
- •Основные характеристики ковалентных связей
- •1. Полярность
- •2. Поляризуемость
- •3. Направленность связей
- •4. Длина связи
- •5. Энергия связи
- •6. Классификация органических реакций по механизму
- •Лекция № 2
- •Алифатические соединения (жирные, ациклические)
- •Способы получения предельных углеводородов
- •Лабораторные способы получения алканов
- •Пространственное строение предельных углеводородов
- •Физические свойства предельных углеводородов
- •Химические свойства предельных углеводородов
- •Получение и свойства алифатических радикалов
- •I тип. Реакция замещения
- •II тип. Реакции окисления
- •III тип. Реакции термического расщепления предельных углеводородов
- •IV тип. Изомеризация предельных углеводородов
- •Лекция 3 этиленовые углеводороды
- •Номенклатура
- •Способы получения
- •Физические свойства олефинов
- •Химические свойства олефинов
- •1. Реакции присоединения
- •Эффект Караша
- •Свойства карбкатионов
- •2. Реакции окисления
- •3. Реакции полимеризации
- •4. Реакции аллильного замещения
- •Отдельные представители
- •Лекция 4 диеновые углеводороды
- •Способы получения
- •Особенности электронного строения диенов с сопряженными связями
- •Физические свойства
- •Химические свойства
- •1. Реакции присоединения
- •2. Реакции окисления
- •3. Реакции полимеризации
- •Натуральный и синтетический каучук
- •Лекция 5 ацетиленовые углеводороды
- •Лабораторные методы получения ацетиленовых углеводородов
- •II. Реакции окисления
- •III. Реакции полимеризации и конденсации
- •Реакции замещения водорода металлом – образование ацетиленидов
- •Изомерия
- •Номенклатура
- •Способы получения
- •Электронное строение
- •Физические свойства
- •Химические свойства
- •I.Реакции нуклеофильного замещения
- •Реакции отщепления галогена
- •III. Реакции отщепления галогеноводорода
- •Лекция 7 галогенопроизводные непредельных углеводородов
- •I. Галогенопроизводные винильного типа. Получение
- •Особенности свойств
- •II. Соединения аллильного типа Получение
- •Получение
- •Отличие в физических и химических свойствах фторуглеводородов
- •Лекция 8 спирты (оксисоединения)
- •Свойства
- •Отдельные представители
- •Многоатомные спирты
- •Способы получения (кроме общих)
- •Физические свойства
- •Химические свойства
- •Рациональная система названий
- •Номенклатура iupac
- •Гомологический ряд предельных монокетонов
- •Способы получения
- •Электронное и пространственное строение карбонильных соединений
- •Физические свойства
- •Химические свойства
- •Лекция 10
- •III. Реакции окисления и восстановления
- •Реакции восстановления
- •Классификация
- •Предельные одноосновные кислоты. Гомологический ряд
- •Изомерия
- •Номенклатура
- •Способы получения
- •1. Окисление углеводородов
- •3. Электронное строение
- •4. Физические свойства предельных одноосновных карбоновых кислот
- •5. Химические свойства карбоновых кислот
- •1) Кислотные свойства
- •4) Дегидратация кислот
- •5) Декарбоксилирование – отщепление со2.
- •Лекция 12 предельные двухосновные кислоты
- •Отличие в свойствах
- •Непредельные кислоты
- •Отличия в свойствах
- •Основные особенности геометрической изомерии
- •Номенклатура
- •Получение
- •Электронное строение нитросоединений
- •Физические свойства
- •Химические свойства
- •1.Определение и классификация
- •2. Изомерия, номенклатура
- •Номенклатура
- •Физические свойства
- •Химические свойства
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Лекция 16 оптическая изомерия Оптическая активность
- •Динамическая стереохимия
- •Стереохимия нуклеофильного замещения
- •Стереохимия электрофильного присоединения
- •Стереохимия отщепления
5. Энергия связи
Теплота, которая затрачена на образование молекулы, определяется экспериментально по энергии образования молекулы, т.к. энергия образования молекулы равна сумме энергий всех связей.
Например: ЕСН4 = 4ЕС-Н
Энергию образования молекулы метана можно определить по теплоте ее сгорания, разделив на 4. Получают энергию связи С-Н.
Связь между одинаковыми атомами часто бывает непрочной, особенно у атомов с высокой электроотрицательностью:
|
Связь |
CI-CI |
N-N |
O-O |
S-S |
Si-Si |
|
Энергия связи, ккал/моль |
58 |
38 |
36 |
63 |
42 |
Связь С-С в отличие от них обладает исключительно высокой прочностью вследствие большей степени перекрывания гибридных орбиталей.
|
Связь |
C-C |
С-Н |
Si-O |
|
Энергия связи, ккал/моль |
83 |
98 |
88 |
Прочность связи С-Н обусловлена отсутствием у водорода внутренних электронных оболочек, которые препятствовали бы приближению атомов углерода. Кроме того, атомы С и Н имеют относительно маленькие размеры, что обеспечивает большую плотность отрицательного заряда между их ядрами.
6. Классификация органических реакций по механизму
Механизмы реакций органических соединений зависят от того, каким образом разрушаются химические связи.
Ковалентная связь может разрушаться двумя основными способами:
-
Разрыв связи, происходящий с разъединением электронной пары, называется гомолитическим расщеплением.
|
|
|
|
+ . H |
Промежуточно при этом образуются активные незаряженные частицы, имеющие неспаренный электрон, свободные радикалы. Так как эти частицы не заряжены – реакции, протекающие с их участием, называют гомеополярными или свободно-радикальными. Образование новой химической связи в этих реакциях идет за счет обобщения неспаренного электрона углерода с неспаренным электроном реагента, например:
|
|
+ Cl : Cl |
|
|
+ Cl . |
Гомеополярные реакции имеют преимущественное значение для соединений с неполярными или малополярными связями.
2. Разрыв связи, происходящий без разъединения электронной пары, называется гетеролитическим расщеплением.
Гетеролитическое расщепление связи приводит к образованию частиц с противоположными зарядами, поэтому такие реакции называются гетерополярными.
Существуют два вида гетерополярных реакций:
а) электронная пара разрушающейся связи остается у атома углерода.
Например:
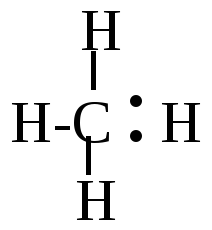
Н\ Н\ Н-C:Н Н-C -: + Н+
Н/ Н/ КАРБАНИОН Образующийся отрицательно заряженный карбониевый ион носит название карбаниона. Образование новой связи в этом случае идет за счет обобщения оставшейся свободной пары электронов углерода с реагентом, который должен иметь положительный заряд или обладать секстетом электронов. Реагент в таких реакциях является частицей электрофильной, поэтому механизм реакции тоже называют электрофильным.
Н \ + - Н \
\ + - Н \
Н -С-
: +Вr : Вr
Н-С-Вr + Вr -
-С-
: +Вr : Вr
Н-С-Вr + Вr -
Н / Н /
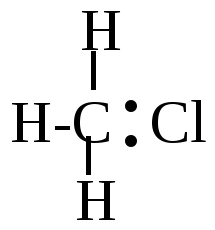
б) электронная пара разрушающейся связи отрывается от углерода. Например: Н\ Н\
H-C:Cl H-C + + :Cl-
H/ H/
КАРБКАТИОН Образуется положительно заряженный углеродный ион, который носит название карбкатиона. Образование новых связей в этом случае происходит за счет обобщения пары электронов реагента, который должен иметь или отрицательный заряд, или неподеленную пару электронов. Например:
Н \ Н\
Н -С+
+ К+ОН- Н-С-ОН
+ К+
-С+
+ К+ОН- Н-С-ОН
+ К+
Н / Н/
Реагент является частицей нуклеофильной, механизм реакции также называется нуклеофильным.
Все гетерополярные реакции легче протекают для соединений с полярными или легко поляризующимися связями и под действием полярных реагентов.
Кроме классификации по механизму, реакции различаются по типам (направлению реакций), например, замещения (S – substitution), присоединения (A – adduction), отщепления (E – elimination), и по молекулярности, по порядку медленной стадии реакции. определяющей скорость всего процесса (моно-, бимолекулярные и др.). Например:
С 2Н5ОН
+ НBr H2O
+ C2H5Br
протекает по механизму SN2
- бимолекулярная реакция
нуклеофильного замещения.
2Н5ОН
+ НBr H2O
+ C2H5Br
протекает по механизму SN2
- бимолекулярная реакция
нуклеофильного замещения.
r=K[C2H5OH][HBr]