
- •Рекомендовано
- •Передмова
- •Загальні методичні вказівки
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2 займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •(Кисле середовище) (нейтральне середовище)
- •(Нейтральне середовище)
- •Гальванічні елементи
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Відповідь: 27822,2 кДж/кг
169. Визначити теплотворну здатність сірки на підставі термохімічного рівняння
![]() .
.
Відповідь: 9278,1 кДж/кг.
170.
Визначити теплоту згоряння
![]() етанолу
етанолу
![]() ,
якщо теплотворна здатність його
,
якщо теплотворна здатність його
![]() .
.
Відповідь: 1366,91кДж/моль.
171. Теплотворна здатність бензину 46861 кДж/кг. Скільки теплоти виділиться при згорянні 10 л його, якщо густина бензину дорівнює 0,70 кг/л?
Відповідь: 78400 кДж.
172.
Визначити теплотворну здатність
антрацену
![]() ,
якщо теплота згоряння його становить
,
якщо теплота згоряння його становить
![]()
Відповідь: 39988,03 кДж/кг.
173.
Теплотворна здатність сірководню
дорівнює
![]() .
Скільки теплоти виділиться при згорянні
1 л газу.
.
Скільки теплоти виділиться при згорянні
1 л газу.
Відповідь: 25,12 кДж.
174.
Визначити теплотворну здатність оксиду
вуглецю (II),
якщо його теплота згоряння
![]() кДж/моль.
кДж/моль.
Відповідь: 12634,4 кДж/м3.
175.
Теплота згоряння етанолу
![]() становить
становить
![]() - 1366,91 кДж/моль
Обчислити теплотворну здатність цієї
рідини.
- 1366,91 кДж/моль
Обчислити теплотворну здатність цієї
рідини.
Відповідь: 29715,4 кДж/кг.
176.
Розрахувати теплотворну здатність
рідкого толуолу
![]() ,
виходячи з його теплоти згоряння
,
виходячи з його теплоти згоряння![]() кДж/моль.
кДж/моль.
Відповідь: 42503,04 кДж/кг.
177. Обчислити теплотворну здатність алюмінію, виходячи з термохімічного рівняння
![]() .
.
Відповідь: 31018,5 кДж/кг.
178. Визначити об’єм вуглекислого газу, що утворюється при повному згорянні вуглецю з виділенням 163962,5 кДж теплоти, якщо теплотворна здатність вуглецю становить 32792,5 кДж/кг.
Відповідь: 9333,3 л.
179.
Розрахувати теплотворну здатність
етану
![]() ,
виходячи з його теплоти згоряння
,
виходячи з його теплоти згоряння
![]() кДж/моль.
кДж/моль.
Відповідь: 69637,5 кДж/м3.
180.
Теплота згоряння бензойної кислоти
![]() становить
становить
![]() -3227,54
кДж/моль. Розрахувати
її теплотворну здатність.
-3227,54
кДж/моль. Розрахувати
її теплотворну здатність.
Відповідь: 26455,2 кДж/м3.
Можливість та напрямленість перебігу реакцій основні поняття та визначення
|
Ентропія S |
-
міра невпорядкованості системи,
функція стану системи.
|
|
Енергія Гіббса (ізобарно-ізотермічний потенціал) G
|
- вільна енергія системи при Р,Т = const. G=H-TS або ΔG = ΔH-TΔS. Розмірність кДж. |
|
Енергія Гіббса утворення речовини ΔGутв |
-
зміна енергії Гіббса системи при
утворенні 1 моль речовини з простих
речовин стійких при 298К. За стандартних
умов ця величина називається стандартною
енергією Гіббса утворення речовини,
Δ
|
|
Енергія Гіббса хімічного процесу |
-
різниця між сумою енергій Гіббса
утворення продуктів реакції і сумою
енергій Гіббса утворення вихідних
речовин з урахуванням стехіометричних
коефіцієнтів
|
|
Критерій можливості самочинного перебігу процесу при P, T=const
|
ΔGP,Т < 0. |
|
Термодинамічна умова хімічної рівноваги |
ΔGP,T = 0. |
Приклади виконання завдань
При виконанні завдань цього розділу див. табл. 4.
Приклад 1. Як зміниться ентропія при перетвореннях:
а) води в пару;
б)
![]() .
Чому?
.
Чому?
Розв’язання.
а)
Перехід
![]() супроводжується збільшенням
невпорядкованості системи і тому
зростанням ентропії
супроводжується збільшенням
невпорядкованості системи і тому
зростанням ентропії
![]() .
.
Оскільки
![]()
б)
Перехід
![]() також супроводжується збільшенням
невпорядкованості системи, тому що
утворюється газоподібна речовина
також супроводжується збільшенням
невпорядкованості системи, тому що
утворюється газоподібна речовина
![]() .
Ентропія системи збільшується, тобто
.
Ентропія системи збільшується, тобто
![]() .
.
Приклад
2. Відновлення
![]() воднем відбувається за рівнянням
воднем відбувається за рівнянням
![]() .
.
Чи можлива ця реакція за стандартних умов?
Розв’язання.
Для відповіді на
запитання слід обчислити
![]() прямої реакції. Знаючи, що
прямої реакції. Знаючи, що
![]() є функцією стану, і що
є функцією стану, і що
![]() простих речовин дорівнюють нулю,
знаходимо
простих речовин дорівнюють нулю,
знаходимо
![]() процесу,
використовуючи перший наслідок із
закону Гесса
процесу,
використовуючи перший наслідок із
закону Гесса

Відповідь.
Реакція неможлива,
оскільки
![]() > 0.
> 0.
Приклад 3. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити зміну енергії Гіббса в реакції відновлення оксиду заліза (III) воднем і визначти можливість самочинного перебігу цієї реакції за стандартних умов.
![]() .
.
Розв’язання.
Згідно з законами
термодинаміки самочинно можуть перебігати
тільки ті реакції, які супроводжуються
зменшенням енергії Гіббса, тобто для
яких
![]() < 0.
< 0.
Враховуючи, що
![]() ,
знаходимо
,
знаходимо
![]() і
і
![]() реакції
реакції
![]()
![]()

Знаходимо
![]()
Відповідь.
Оскільки
![]() то самочинний перебіг даної реакції за
стандартних умов неможливий.
то самочинний перебіг даної реакції за
стандартних умов неможливий.
Приклад
4. Виходячи з
припущення, що
![]() і
і
![]() не залежать від температури, визначити
за якої температури рівновага системи
не залежать від температури, визначити
за якої температури рівновага системи
![]()
зміститься вправо?
Розв’зання.
Відповідно до законів
термодинаміки критерієм можливості
перебігу хімічних реакцій є зміна
ізобарно-ізотермічного потенціалу
(енергії Гіббса)
![]() .
Самочинно можуть відбуватися тільки
ті процеси, для яких він зменшується,
тобто
.
Самочинно можуть відбуватися тільки
ті процеси, для яких він зменшується,
тобто
![]() <0.
Якщо
<0.
Якщо
![]() >0,
то процес самочинно відбуватися не
може. При
>0,
то процес самочинно відбуватися не
може. При
![]() система знаходиться в рівновазі.
система знаходиться в рівновазі.
Знаходимо температуру, при якій встановиться рівновага даної реакції, із співвідношення
![]() .
.
Оскільки умовою рівноваги є
![]() ,
то і
,
то і
![]() =0.
=0.
Тоді
![]() і
і
 .
.
Починаючи з цієї температури,
можливий самочинний перебіг реакції.
Цю температуру називають температурою
початку реакції. Використовуючи перший
наслідок із закону Гесса, знаходимо
![]() та
та
![]() .
.


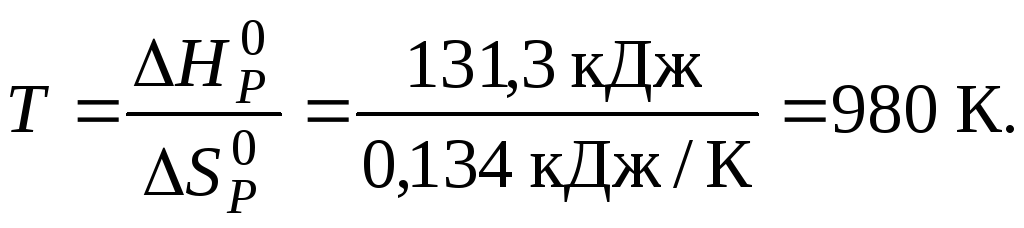
Отже, при
![]() в системі встановиться рівновага, тобто
однаково ймовірні прямий та зворотний
напрямки реакцій. При температурах, що
перевищують 980К, рівновага зміститься
вправо, тобто відбуватиметься пряма
реакція, а при температурах нижче 980К
рівновага зміститься вліво, відбуватиметься
зворотна реакція.
в системі встановиться рівновага, тобто
однаково ймовірні прямий та зворотний
напрямки реакцій. При температурах, що
перевищують 980К, рівновага зміститься
вправо, тобто відбуватиметься пряма
реакція, а при температурах нижче 980К
рівновага зміститься вліво, відбуватиметься
зворотна реакція.
