
- •Основы металлургического производства
- •1. Основы металлургического производства
- •Основные тенденции развития металлургического производства:
- •1.1.Основы теории металлургических процессов
- •1.1.1. Окислительно-восстановительные химические реакции в металлургических процессах
- •Закон действия масс
- •1.1.3. Роль температуры, флюсов, шлаков и огнеупорных материалов в металлургических процессах Роль температуры в металлургических процессах
- •Роль флюсов в металлургических процессах
- •Роль огнеупоров в металлургических процессах
- •1.2. Производство чугуна
- •1.2.1.Подготовка руды к плавке
- •Окускование железорудного сырья
- •1.2.2.Конструкция доменной печи
- •Исходные материалы для получения чугуна
- •1.2.3. Доменный процесс получения чугуна
- •1.2.4. Продукты доменного производства
- •1.1.5. Технико-экономические показатели работы доменной печи
- •1.3. Производство стали
- •Классификация способов получения стали
- •1.3.1. Двухстадийная схема получения стали
- •Получение стали в мартеновской печи
- •Основные технико-экономические показатели производства в мартеновских печах
- •Производство стали в электропечах
- •Устройство дуговой электропечи
- •Технико-экономические показатели
- •Выплавка стали в индукционных печах
- •Производство стали в кислородном конвертере
- •Физико-химические процессы, протекающие при получении стали из передельного чугуна
- •1.3.2. Получение стали методом прямого восстановления
- •1.3.3. Способы разливки стали
- •1.4.Способы улучшения качества металла
- •Внепечная обработка жидкого металла
- •Обработка стали синтетическими шлаками
- •Вакуумирование стали в ковше
- •Продувка аргоном стали в ковше
- •Способы переплавки в специальных печах
- •Электрошлаковый переплав ( эшп )
- •Вакуумно-дуговой переплав
- •Плазменно-дуговой переплав
- •Электронно-лучевой переплав (элп)
-
Закон действия масс
По мере протекания химических реакций количество исходных веществ уменьшается, и накапливаются продукты химических реакций, в результате устанавливается равновесие. Модельную химическую реакцию представим в виде:
 (
3 )
(
3 )
Скорость прямой химической реакции V1 (моль/л.с) может быть рассчитана по формуле
V1 =K1[ AB] [C] ( 4 )
а скорость обратной химической реакции рассчитывается по формуле
V2 = K2 [AC] [B] ( 5 )
где [AB] ,[C] -концентрации исходных веществ, моль/л.
[AC] , [B] - концентрация продуктов химической реакции, моль/л ;
K , K1 - константы скорости прямой и обратной химических реакций, л/мольс.
Константы химических реакций зависят от температуры по закону Аррениуса
K = Ko exp ( - Ea /RT ) ( 6 )
где Ea - энергия активации химических реакций, Дж/моль; R - газовая постоянная, R = 8.314 Дж/(моль К); K - константа скорости химической реакции.
По мере протекания прямой химической реакции количество
исходных веществ уменьшается, а обратной химической реакции возрастает, в конечном счете, в состоянии равновесия.
V1 = V2 ( 7 )
Из равенства (7) следует
![]() (
8 )
(
8 )
Равенство, которое связывает концентрации исходных веществ и продуктов химических реакций или парциальных давлений газов в условиях равновесия, называется законом действия масс. При Кр < 1, равновесие смещено влево; Кр> 1, равновесие смещено вправо.
1.1.3. Роль температуры, флюсов, шлаков и огнеупорных материалов в металлургических процессах Роль температуры в металлургических процессах
Температура в реакционной зоне металлургических процессах играет очень важную роль:
-
определяет скорость протекания химических реакций по закону Аррениуса: экспоненциально зависит от температуры; с ростом температуры скорость химических реакций сильно возрастает;
-
определяет принципиальную возможность проведения металлур-гических процессов по извлечению металлов из окислов металлов (должно выполняться условие Ро2(вн) < Ро2 (МеО).
Температура в реакционной зоне металлургической печи определяется температурой горения металлургического топлива.
Температура
горения металлургического топлива
может быть рассчитана по формуле
Менделеева, которая имеет вид:
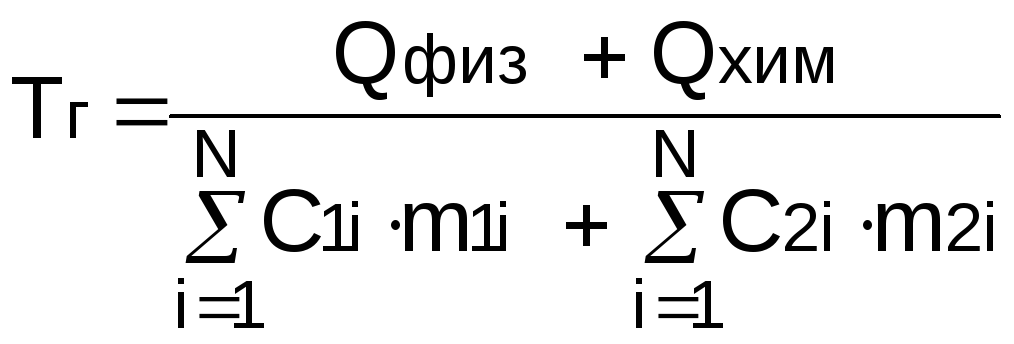 , ( 9 )
, ( 9 )
где Qфиз - тепло, которое вносится в печь нагретыми исходными
веществами горения топлива; Qхим - теплотворная способность металлургического топлива; С2i, m2i - теплоемкости и массы исходных веществ, участвующих в горении; С2i, m2i - теплоемкости и массы продуктов горения металлургического топлива.
Пути повышения температуры горения металлургического топлива: подогрев исходных веществ; использование металлур-гического топлива с большей теплотворной способностью; обогаще-ние воздуха, участвующего в горении, кислородом (снижение парциального давления азота); измельчение металлургического топлива.
Выбор оптимального избытка кислорода по сравнению с теоретическим количеством необходим для сгорания топлива.
C + O2 = CO2 + ( -1 ) O2 ( 10 )
где - избыточное количество кислорода по сравнению со стехиометрической величиной (оптимальное значение = 1.02...1.05). Оптимальная величина зависит от размеров частиц твердого и жидкого топлива.
