
- •Общие методические указания
- •Концентрация растворов
- •Растворимость веществ
- •Давление пара разбавленных растворов неэлектролитов. Первый закон рауля
- •Электролитическая диссоциация
- •Закон разбавления Оствальда, связывающий три величины: Кд, с и α, выражается уравнением .
- •Активная концентрация ионов сильных электролитов
- •Молекулярно-ионные уравнения реакций между растворами электролитов
- •Ионное произведение воды. Водородный показатель
- •Гидролиз солей
- •Жесткость воды и методы ее устранения
- •Строение коллоидных частиц
- •Коагуляция золей. Порог коагуляции электролитов
- •Микробиология
- •Приложение
- •Константы диссоциации некоторых слабых электролитов
- •Коэффициенты активности ионов
- •Литература
- •Рабочая программа химия воды и микробиология
- •6. Содержание:
- •6.1. Календарный план
- •Вид занятий – лекции
- •Вид занятий – лабораторный практикум
- •Самостоятельная работа студентов Проработка лекционного материала
- •Подготовка к лабораторным занятиям, контрольной работе и экзамену
- •6.4. Формы контроля экзаменационные вопросы
- •Примерные экзаменационные задачи
- •Список рекомендуемых документов основная литература
- •Дополнительная литература
- •Перечень методических пособий и указаний для студентов
Коагуляция золей. Порог коагуляции электролитов
Коагуляция — это процесс укрупнения дисперсных частиц за счет их взаимодействия и объединения в агрегаты. Мелкие (первичные) частицы в таких агрегатах соединены силами межмолекулярного взаимодействия. Слипание однородных частиц называется гомокоагуляцией, а разнородных—гетерокоагуляцией. Вещества, способные вызвать коагуляцию частиц называют в общем случае коагуляторами, а в водоподготовке—коагулянтами или гидролизующимися коагулянтами. Последние не только вызывают коагуляцию частиц загрязнений, но и образуют, гидролизуясь, малорастворимые продукты, способные объединяться в крупные хлопья.
Под устойчивостью дисперсной системы понимают постоянство во времени ее состояния и основных свойств: дисперсности, равномерного распределения частиц дисперсной фазы в объеме дисперсной среды и характера взаимодействия между частицами.
Коагуляция под действием электролитов подчиняется правилу Шульце и Гарди, которое формулируется следующим образом: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы: коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора. Соотношение коагулирующей способности одно-, двух- и трехвалентных ионов приблизительно равно 1 : 30 : 1000.
Критическое значение концентрации, при котором данный электролит вызывает коагуляцию, называют порогом коагуляции и обозначают Ск (моль/л или ммоль/л).
Величину, обратную порогу коагуляции, называют коагулирующей способностью и обозначают Vk =Сk-1 . Коагулирующая способность выражает число объемов золя, скоагулированного 1 моль (или 1 ммоль) иона-коагулятора.
Пример 1. Вычисление порога коагуляции электролита с учетом его концентрации. В каждую из трех колб налито по 0,01 л золя хлорида серебра. Для коагуляции золя в первую колбу добавлено 0,002 л 1 н. NаNО3 во вторую — 0,012 л 0,01 н. Са(NО3)2, а в третью — 0,007л 0,001 н. А1(NО3)3. Вычислите пороги коагуляции электролитов и определите знак заряда частиц золя.
Решение. Минимальное количество Электролита, прибавляемого к золю, которое может вызвать коагуляцию золя, называется порогом коагуляции с. Порог коагуляции принято выражать в миллимолях (ммоль) или миллиграмм-эквивалентах (мг-экв) электролита на 1 л золя.
Порог коагуляции можно вычислить по формуле
![]()
где N — концентрация электролита, г-экв/л; Vэл — объем электролита, л;
Vз — объем золя, л.
Вычисляем пороги коагуляции добавляемых электролитов;
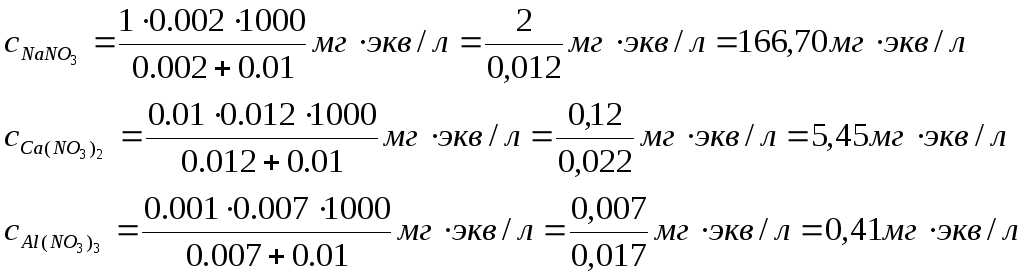
Добавляемые электролиты — NaNO3, Са(NО3)2 и Al(NO3)3 — содержат анион NO3- и катионы Na+, Ca2+, Al3+ разной зарядности. Наименьший порог коагуляции у А1(NО3)3, следовательно, частицы золя хлорида серебра заряжены отрицательно.
Пример 2. Вычисление порога коагуляции электролита с учетом заряда иона-коагулятора. Порог коагуляции раствора КNО3 для золя гидроксида алюминия, частицы которого заряжены положительно, равен 60,0 ммоль/л. Рассчитайте порог коагуляции К3[Fе(СN)6] для этого золя.
Решение. Коагуляцию золя вызывает тот из ионов прибавленного электролита, заряд которого противоположен заряду коллоидной частицы. Коагулирующая способность иона определяется его зарядом: чем больше заряд иона, тем больше его коагулирующая способность. Значения порогов коагуляции электролитов с одно-, двух- и трехзарядными ионами относятся как числа 729 : 11 : 1. Следовательно, порог коагуляции К3(Fе(СN)6] будет в 729 раз меньше, чем у КNО3, т. е. Скз[Fе(СN)6] = 60/729 = 0,082 ммоль/л.
Задачи
201. Пороги коагуляции золя электролитами оказались равными (мг-экв/л): CNaNOз = 250,0, CMg(NOз)2= 20,0, CFe(NOз)з = 0,5. Какие ионы электролитов являются коагулирующими? Как заряжены частицы золя?
202. Вычислите порог коагуляции раствора сульфата натрия, если добавление 0,003 л 0,1 н. Na2SO4 вызывает коагуляцию 0,015 л золя.
203. Как расположатся пороги коагуляции в ряду CrCl3, Ва(NО3)2, K2SO4 для золя кремниевой кислоты, частицы которого заряжены отрицательно?
204. Какой объем 0,0002М Fе(NО3)3 требуется для коагуляции 0,025 л золя сульфида мышьяка, если порог коагуляции СFе(NОз)з, = 0,067 мг-экв/л?
205. В три колбы налито по 0,1 л золя гидроксида железа. Для того чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 0,01 л 1 н. NH4C1, в другую —0,063 л 0,01 н. Na2SO4, в третью —0,037 л 0,001 н. Nа3РO4. Вычислите порог коагуляции каждого электролита и определите знак заряда частиц золя.
206. Золь гидроксида меди получен при сливании 0,1 л 0,05 н. NaOH и 0,25 л 0,001 н. Сu(NО3)2. Какой из прибавленных электролитов : КВг, Ва(NО3)2, К2СгO4, MgSO4, А1С13 — имеет наименьший порог коагуляции?
207. Золь сульфида кадмия получен смешиванием равных объемов растворов Na2S и Сd(NО3)2. Пороги коагуляции для различных электролитов имеют следующие значения (мг-экв/л); С(Cа(NO3)2) = 265; C(NaCl) = 250, C(MgCl2) = 290, C(Na3PO4) = 0,4; C(Na2SO4) =15, C(AlCl3)=300. Какой из электролитов: Na2S или Сd(NО3)2—взят в избытке для приготовления золя?
208. Коагуляция золя иодида серебра, частицы которого заряжены отрицательно, вызывается катионами добавляемых электролитов. Порог коагуляции LiNО3 для этого золя равен 165 ммоль/л. Вычислите порог коагуляции Ва(NО3)2 и А1(NO3)3 для этого золя.
209. Как изменится порог коагуляции электролита для золя бромида серебра, частицы которого заряжены положительно, если для коагуляции 0,1 л золя вместо 0,0015 л 0,1 н. К2SО4 взят раствор Fе(NO3)3?
210. Для коагуляции 0,05 л золя сульфида мышьяка можно добавить один из следующих растворов электролитов: 0,005 л 2 н. NaCl; 0,005 л 0,03 н. Na2SO4; 0,004 л 0,0005 н. Na4[Fe(CN)6]. У какого из приведенных электролитов наименьший порог коагуляции?
211. Порог коагуляции АlСl3 для золя оксида мышьяка равен 0,093 мг-экв/л. Какой концентрации нужно взять раствор А1С13, чтобы 0,0008 л его хватило для коагуляции 0,125 л золя?
212. Вычислите порог коагуляции раствора сульфата натрия, если добавление 0,006 л 0,2 н. Na2SO4 вызывает коагуляцию 0,015 л золя.
213. Какой объем 0,0004М Fе(NО3)3 требуется для коагуляции 0,025 л золя гидроксида меди, если порог коагуляции СFе(NОз)з, = 0,067 мг-экв/л?
214. В три колбы налито по 0,1 л золя гидроксида алюминия. Для того чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 0,02 л 2 н. NH4C1, в другую —0,032 л 0,005 н. Na2SO4, в третью —0,064 л 0,002 н. Nа3РO4. Вычислите порог коагуляции каждого электролита и определите знак заряда частиц золя.
215. Золь гидроксида никеля получен при сливании 0,1 л 0,05 н. NaOH и 0,25 л 0,001 н. Ni(NО3)2. Какой из прибавленных электролитов : NaВг, Ва(NО3)2, К2СгO4, MgSO4, А1С13 — имеет наименьший порог коагуляции?
216. Золь сульфида свинца получен смешиванием равных объемов растворов Na2S и Pb(NО3)2. Пороги коагуляции для различных электролитов имеют следующие значения (мг-экв/л); С(Cа(NO3)2) = 265; C(NaCl) = 250, C(MgCl2) = 290, C(Na3PO4) = 0,4; C(Na2SO4) =15, C(AlCl3)=300. Какой из электролитов: Na2S или Pb(NО3)2—взят в избытке для приготовления золя?
217. Коагуляция золя хлорида серебра, частицы которого заряжены отрицательно, вызывается катионами добавляемых электролитов. Порог коагуляции LiNО3 для этого золя равен 165 ммоль/л. Вычислите порог коагуляции Ва(NО3)2 и А1(NO3)3 для этого золя.
218. Как изменится порог коагуляции электролита для золя иодида серебра, частицы которого заряжены положительно, если для коагуляции 1 л золя вместо 0,015 л 0,1 н. К2SО4 взят раствор Fе(NO3)3?
219. Для коагуляции 0,01 л золя сульфида мышьяка можно добавить один из следующих растворов электролитов: 0,001 л 2 н. NaCl; 0,001 л 0,03 н. Na2SO4; 0,0008 л 0,0005 н. Na4[Fe(CN)6]. У какого из приведенных электролитов наименьший порог коагуляции?
220. Порог коагуляции АlСl3 для золя оксида мышьяка равен 0,093 мг-экв/л. Какой концентрации нужно взять раствор А1С13, чтобы 0,004 л его хватило для коагуляции 0,53 л золя?
