
- •Общие методические указания
- •Концентрация растворов
- •Растворимость веществ
- •Давление пара разбавленных растворов неэлектролитов. Первый закон рауля
- •Электролитическая диссоциация
- •Закон разбавления Оствальда, связывающий три величины: Кд, с и α, выражается уравнением .
- •Активная концентрация ионов сильных электролитов
- •Молекулярно-ионные уравнения реакций между растворами электролитов
- •Ионное произведение воды. Водородный показатель
- •Гидролиз солей
- •Жесткость воды и методы ее устранения
- •Строение коллоидных частиц
- •Коагуляция золей. Порог коагуляции электролитов
- •Микробиология
- •Приложение
- •Константы диссоциации некоторых слабых электролитов
- •Коэффициенты активности ионов
- •Литература
- •Рабочая программа химия воды и микробиология
- •6. Содержание:
- •6.1. Календарный план
- •Вид занятий – лекции
- •Вид занятий – лабораторный практикум
- •Самостоятельная работа студентов Проработка лекционного материала
- •Подготовка к лабораторным занятиям, контрольной работе и экзамену
- •6.4. Формы контроля экзаменационные вопросы
- •Примерные экзаменационные задачи
- •Список рекомендуемых документов основная литература
- •Дополнительная литература
- •Перечень методических пособий и указаний для студентов
Жесткость воды и методы ее устранения
Жесткость воды обусловливается содержанием в ней растворимых солей, преимущественно гидрокарбонатов, сульфатов, хлоридов кальция, магния, железа (II) и др., которые делают воду непригодной для многих технологических процессов.
В зависимости от того, какие соли присутствуют в воде, различают два вида жесткости: карбонатную (временную) Жв и некарбонатную (постоянную) Жп.
Карбонатную жесткость воде придают гидрокарбонаты кальция, магния и железа (II): Ca(HCO3)2, Mg(HCO3)2, Fe(HCO3)2 и др. При кипячении карбонатная жесткость устраняется за счет разложения гидрокарбонатов, при этом выпадает осадок в виде накипи:
Ca(HCO3)2![]() CaCO3
+ CO2
+ H2O
CaCO3
+ CO2
+ H2O
Mg(HCO3)2![]() MgCO3
+ CO2
+ H2O
MgCO3
+ CO2
+ H2O
Разложение гидрокарбоната магния сопровождается гидролизом образующегося карбоната с образованием осадков (MgOH)2CO3 и Mg(OH)2:
3MgCO3
+ 2H2O
![]() (MgOH)2CO3
+ Mg(OH)2
+ 2CO2
(MgOH)2CO3
+ Mg(OH)2
+ 2CO2
Разложение гидрокарбоната железа (II) сопровождается полным его гидролизом до Fe(OH)2 с одновременным окислением в Fe(OH)3:
4Fe(HCO3)2 + O2 +2H2O = 4Fe(OH)3 + 8CO2.
Карбонатную жесткость можно устранить также добавлением в виде щелочи (обычно гидроксида кальция), например:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O.
Некарбонатную жесткость воде придают хлориды и сульфаты кальция и магния: CaCl2, MgCl2, CaSO4, MgSO4 и др. Эти соли при кипячении воды остаются в растворе, поэтому некарбонатную жесткость нельзя устранить кипячением воды. Ее устраняют химическим путем, например добавлением карбоната натрия (соды) Na2CO3, фосфата натрия (Na3PO4) или гидроксида кальция (гашеной извести) Са(ОН)2.
Жесткость измеряется в единицах по ГОСТу. Единица жесткости по ГОСТу - жесткость воды, содержащей 1 мг-эквивалент Ca2+ или Mg2+ на 1 л воды или 1 г-эквивалент на 1 м3 воды. 1° жесткости равен 1 г СаО в 100 л воды. Содержание других металлов пересчитывается на эквивалентное количество СаО. Вода, жесткость которой равна до 4 мг-экв/л, считается мягкой, свыше 12 мг-экв/л — очень жесткой.
Общая жесткость воды показывает содержание миллимоль гидрокарбонатов, сульфатов и хлоридов кальция и магния в 1 дм3 воды. Жесткость карбонатная и некарбонатная составляют общую жесткость Жо воды: Жо = Жв + Жп.
В промышленности жесткость воды устраняют при помощи ионитов. Обменной емкостью катионита называется максимальное количество ионов, поглощаемое 1 г катионита обменным путем. Обменная емкость катионита выражается в мг-экв/г или мг-экв/л.
Пример 1. Определение общей жесткости воды по количеству содержащихся в воде солей. Рассчитайте общую жесткость воды (в мг-экв/л и градусах), если в 0,15 л воды содержится 16,20 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния.
Решение. Жесткость воды Ж выражается в миллиграмм-эквивалентах двухзарядных катионов металлов Са2+, Mg2+, Fe2+ и других или соответствующих им солей, содержащихся в 1 л воды:
![]()
где m1, m2, m3 - содержание в воде двухзарядных катионов металлов (или соответствующих им солей), мг; Э1, Э2, Э3 - эквиваленты катионов металлов (или соответствующих им солей); V - объем воды, л.
Определяем эквиваленты солей, обусловливающих жесткость воды
Са(НСО3)2 Мg(НСО3)2
Э=М/2= 162,11/2=81,05; Э=М/2= 146,34/2=73,17;
CaCl2 MgCl2
Э=М/2= 110,99/2=55,49; Э = М/2 = 95,21/2 = 47,60.
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости и обусловливается содержанием в ней солей, придающих ей жесткость; она равна:
![]() мг·экв/л
мг·экв/л
1° жесткости соответствует 0,357 мг-экв катионов двухзарядных металлов. Общая жесткость образца воды в градусах жесткости равна 2,560/0,357= 7,17°. Вода данного образца считается мягкой.
Пример 2. Определение временной (гидрокарбонатной) жесткости воды по объему соляной кислоты, пошедшей на ее титрование. Найдите временную жесткость воды, если на титрование 0,1 л образца воды, содержащей карбонат магния, израсходовано 7,2· 10-3 л 0,13 н. НС1.
Решение. При титровании воды соляной кислотой происходит следующая химическая реакция:
Mg(HCO3)2 + 2НС1 = MgCl2 + 2CO3 + 2Н2О
В соответствии с законом эквивалентов число грамм-эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. На титрование 0,1 л воды израсходовано 0,13·7,2·10-3 = 0,936·10-3 грамм-эквивалентов НС1. Следовательно, такое же число грамм эквивалентов магния содержится в воде, т. е.
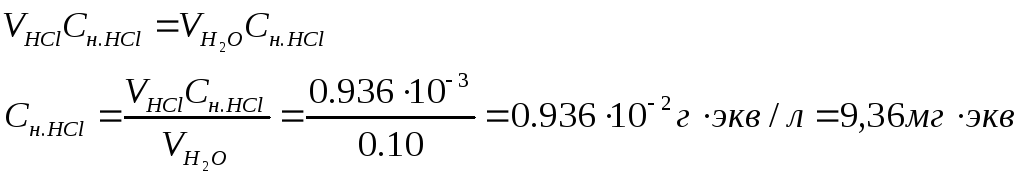
Жесткость данного образца воды равна 9,36 мг-экв/л (вода средней жесткости)
Пример 3. Определение временной и постоянной жесткости воды по количеству реагентов, необходимых для устранения жесткости. Для устранения общей жесткости по известково-содовому методу к 50 л воды добавлено 7,4 г Са(ОН)2 и 5,3 г Na2СО3. Рассчитайте временную и постоянную жесткость воды.
Решение. Добавление к воде Ca(OH)2 может устранить временную жесткость, а добавление Na2CO3 — постоянную жесткость. При добавлении этих реагентов к воде происходят следующие химические реакции:
Ме(НСО3)2 + Са(ОН)2 = ↓ МеСО3 + ↓ CaCO3 + 2Н2О
Ме(NО3)2 + Na2CO3 = ↓ МеСО3 + 2NaNO3
(Me2+: Ca2+, Mg2+, Fe2+ и др.)
Временная жесткость воды Жвр измеряется числом миллиграмм-эквивалентов гидроксида кальция, участвующего в реакции, а постоянная жесткость Жпост - числом миллиграмм-эквивалентов карбоната натрия:
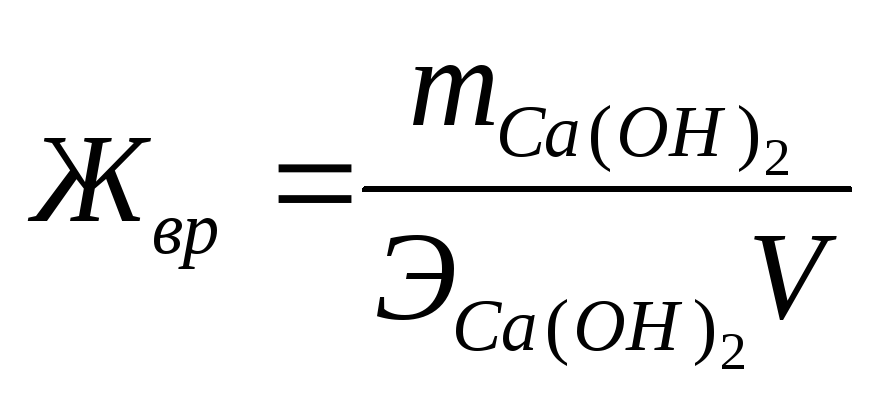
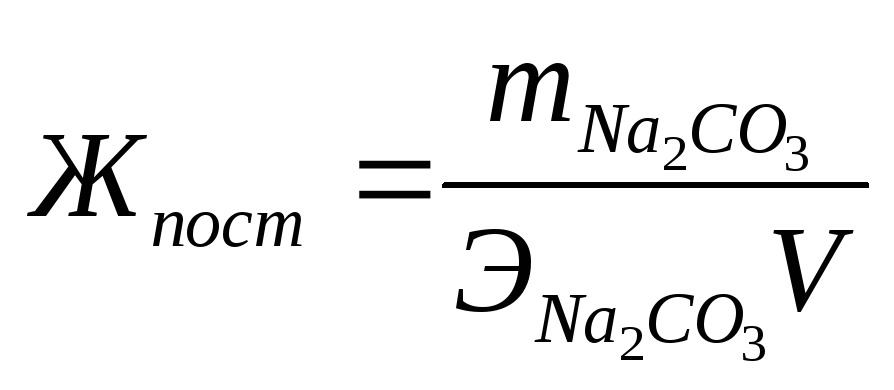
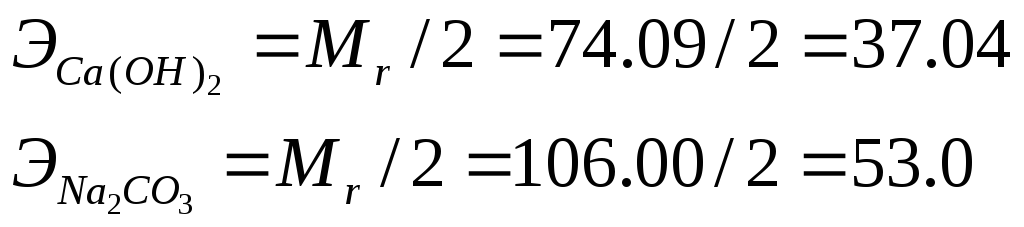
Жвр == 7400/(37,04 • 50) = 4 мг-экв/л;
Жпост = 5300/(53,0 • 50) == 2 мг-экв/л.
Общая жесткость воды равна
Жобщ = Жвр + Жпост =4+2=6 мг-экв/л (вода средней жесткости).
Пример 4. Определение обменной емкости катионита, применяемого для устранения жесткости воды. Вычислите обменную емкость сульфоугля, если через адсорбционную колонку, содержащую 50 г сульфоугля, пропущено 11,35 л воды с общей жесткостью 8,5 мг-экв/л (до появления катионов Ca2+ и Mg2+ в фильтрате).
Решение. Обменная емкость ε катионита определяется с помощью соотношения
ε=ЖV/m,
где V — объем воды, пропущенной через катионит, л; т— масса катионита, г.
Обменная емкость сульфоугля равна
ε=8,5 ·11,35/50=1.93 мг-экв/г.
Задачи
161. Один литр образца воды содержит 48,6 мг дикарбоната кальция и 29,6 мг сульфата магния. Сколько молей Са2+ и Mg2+ содержится в 1 л образца воды? Чему равна общая жесткость воды?
162. Растворимость CaSO4 в воде при 20° С равна 0,202 г/100 г раствора. Плотность насыщенного раствора CaSO4 равна 1000 кг/м3. Вычислите жесткость этого раствора.
163. Чему равна жесткость (в г-экв/л и градусах) 0,005 М CaCI2?
164. Жесткость некоторого образца воды обусловливается только дикарбонатом железа. При кипячении 0,25 л воды в осадок выпадает 4 мг FeCO3. Чему равна жесткость воды?
165. На титрование 0,05 л образца воды израсходовано 4,8·10-3 л 0,1 н. НСl. Чему равна карбонатная жесткость воды?
166. При определении временной жесткости на титрование 0,1 л воды израсходовано 5,25·10-3 л 0,101 н. НСl. Чему равна временная жесткость воды?
167. Сколько гашеной извести надо прибавить в 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 мг-экв/л?
168. Для умягчения 100 л воды потребовалось 12,72 г Na2CO3. Чему равна жесткость воды (в градусах и мг-экв/л)?
169. Жесткость, некоторого образца воды обусловливается только нитратом кальция. При обработке 0,25 л образца воды карбонатом натрия в осадок выпало 37,8 мг СаСО3. Чему равна жесткость воды (в градусах)?
170. Общая жесткость волжской воды равна 6,52 мг-экв/л, а временная 3,32 мг-экв/л. Сколько Са(ОН)2 и Na2CO3 надо взять, чтобы устранить жесткость 5 л воды?
171. Некарбонатная жесткость воды равна 3,18 мг-экв/л. Сколько Na3PO4 надо взять, чтобы умягчить 1 м3 такой воды?
172. Чему равна постоянная жесткость воды, если для ее устранения к 25 л воды добавлено 21,6 г буры Na2B4O7· 10H2O?
173. Рассчитайте обменную емкость катионита марки КУ-2, если через адсорбционную колонку, содержащую 100 г этого ионита, пропустили 25 л воды общей жесткостью 13,6 мг-экв/л.
174. Обменная емкость катионита-пермутита Nа2О·Аl2О3·nН2О равна 7,2 мг-экв/л. Какова величина устраненной жесткости воды, если через 200 г этого катионита пропущено 50 л воды?
175. Обменная емкость каолиновой глины составляет 13,5 мг-экв/л. Сколько литров воды общей жесткостью 3,5 мг-экв/л можно профильтровать через 150 г глины для полного удаления катионов Ca2+ и Mg2+?
176. Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, не карбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния?
177. Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 мэкв.
178. Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 сульфата калия.
179. Какие ионы надо удалить из природной воды, чтобы сделать ее мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций. Какую-массу Са(ОН)2 надо прибавить к 2,5 л Воды, чтобы устранить ее жесткость, равную 4,43 мэкв/л?
180. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция?
