
- •Розділ 1. Механіка
- •§ 1.1. Кінематика механічного руху
- •§ 1.2. Швидкість і прискорення
- •§ 1.3. Кінематика обертового руху матеріальної точки
- •§ 1.4 Закони динаміки. Поняття маси, сили, імпульсу, імпульсу сили. Інерціальні системи відліку
- •§ 1.5. Імпульс системи. Закон збереження імпульсу
- •§ 1.6. Центр мас (інерції) системи. Закон руху центра мас
- •§ 1.7. Межі застосування класичного опису частинок
- •§ 1.8. Основний закон динаміки поступального руху твердого тіла
- •§ 1.9. Динаміка обертового руху твердого тіла відносно осі. Поняття моменту інерції, моменту сили та моменту імпульсу твердого тіла.
- •§ 1.10. Закон збереження моменту імпульсу твердого тіла відносно осі
- •§ 1.11. Поняття енергії і роботи. Робота сили. Потужність.
- •§ 1.12. Кінетична енергія. Теорема про зміну кінетичної енергії.
- •§ 1.13. Потенціальні і непотенціальні сили
- •§ 1.14. Потенціальна енергія та її зв’язок з потенціальними силами
- •§ 1.15. Потенціальна енергія гравітаційної взаємодії
- •§ 1.16. Потенціальна енергія пружної взаємодії
- •§ 1.17. Повна механічна енергія. Закон збереження повної механічної енергії.
- •§ 1.18. Графічне представлення енергії
- •§ 1.19. Перетворення координат Галілея
- •§ 1.20. Інерціальні системи відліку. Механічний принцип відносності
- •§ 1.21. Неінерціальні системи відліку. Сили інерції
- •§ 1.22. Властивості простору і часу у класичній механіці
- •§ 1.23. Постулати спеціальної теорії відносності (ств). Перетворення Лоренца
- •§ 1.24. Властивості простору і часу в релятивістській механіці (наслідки із перетворень Лоренца)
- •§ 1.25. Правила додавання швидкостей в релятивістській механіці
- •§1.26 Релятивістський імпульс
- •§1.27 Основний закон динаміки теорії відносності. Релятивістська енергія
- •§1.28 Зв’язок енергії з імпульсом і маси з енергією спокою
- •§ 1.29. Гідростатика нестисливої рідини. Закон Паскаля. Гідростатичний тиск. Закон Архімеда
- •§ 1.30. Рух ідеальної рідини. Рівняння нерозривності. Рівняння Бернуллі
- •§ 1.31. Гідродинаміка в’язкої рідини. Сила Стокcа
- •Розділ 2. Основи молекулярної фізики і термодинаміки
- •§ 2.1. Статистичний і термодинамічний методи дослідження. Тепловий рух. Основні поняття
- •§ 2.2. Рівняння стану ідеального газу
- •§ 2.3. Основне рівняння молекулярно-кінетичної теорії газів
- •§ 2.4. Середня квадратична швидкість молекул. Молекулярно-кінетичне тлумачення температури
- •§ 2.5. Розподіл Максвела молекул за швидкостями та енергіями
- •§ 2.6. Барометрична формула. Розподіл Больцмана частинок у потенціальному полі
- •§ 2.7. Внутрішня енергія системи. Теплота і робота
- •§ 2.8. Робота розширення (стискання) газу
- •§ 2.9. Перше начало термодинаміки та його застосування до ізопроцесів
- •§ 2.10. Середня кінетична енергія молекул. Внутрішня енергія ідеального газу
- •§ 2.11. Теплоємність газів. Недоліки класичної теорії теплоємностей
- •§ 2.12. Адіабатичний процес. Рівняння Пуасона
- •§ 2.13. Оборотні та необоротні процеси. Цикли
- •§ 2.14. Цикл Карно. Максимальний ккд теплової машини
- •§ 2.15. Друге начало термодинаміки. Нерівність Клаузіуса
- •§ 2.16. Ентропія. Закон зростання ентропії
- •§ 2.17. Статистичний зміст другого начала термодинаміки
- •§ 2.18. Ефективний діаметр молекули. Середнє число зіткнень і середня довжина вільного пробігу
- •§ 2.19. Явища перенесення
- •§ 2.20. Молекулярно-кінетична теорія явищ перенесення
- •§ 2.21. Реальні гази. Рівняння Ван-дер-Ваальса
- •§ 2.22. Ізотерми Ван-дер-Ваальса. Метастабільні стани. Критична точка
- •§ 2.23. Характер теплового руху в рідинах. Поверхневий натяг. Явище змочування. Капілярні явища
- •§ 2.24. Характер теплового руху у твердих тілах. Теплоємність і теплове розширення твердих тіл
- •§ 2.25. Фази і фазові перетворення. Умови рівноваги фаз. Потрійна точка
- •§ 2.26. Рівняння Клапейрона-Клаузіуса
- •§ 2.27. Фазові діаграми
- •§ 3.1.Електричний заряд. Електричне поле. Закон Кулона. Напруженість та індукція електричного поля. Принцип суперпозиції електричних полів
- •§ 3.2. Потік вектора напруженості та індукції електричного поля. Теорема Остроградського-Гауса
- •§ 3.3. Розрахунок електричних полів за допомогою теореми Остроградського-Гауса
- •§ 3.4. Робота сил електричного поля. Теорема про циркуляцію вектора напруженості електричного поля. Потенціал
- •§ 3.5. Розрахунок потенціалу електричного поля деяких заряджених тіл
- •§ 3.6. Провідники в електричному полі. Електроємність відокремленого провідника
- •§ 3.7. Конденсатори. Електроємність конденсатора. З’єднання конденсаторів
- •§ 3.8. Енергія зарядженого тіла і конденсатора. Енергія і густина енергії електричного поля
- •§ 3.9. Діелектрики в електричному полі. Поляризація діелектриків
- •§ 3.10. Електричний струм. Закон Ома для ділянки кола. Закон Ома в диференціальній формі
- •§ 3.11. Електрорушійна сила джерела струму. Закон Ома для неоднорідної ділянки кола і для повного кола
- •§ 3.12. Розгалужені електричні кола. Закони Кірхгофа. З’єднання провідників
- •§ 3.13. Робота і потужність струму. Закон Джоуля-Ленца
- •§ 3.14. Електричний струм в металах. Термоелектронна емісія. Контактні явища
- •§ 3.15. Електричний струм в електролітах
- •§ 3.16. Електричний стум в газах. Плазма
- •§ 3.17. Електричний струм у вакуумі
§ 2.8. Робота розширення (стискання) газу
Розрахуємо
роботу, що виконується газом при зміні
його об’єму. Нехай газ поміщений в
циліндричну посудину під тісно підігнаним
поршнем, що може легко рухатися (рис.
2.6). З боку газу на поршень діє сила тиску
F=pS,
де р
– тиск, S
– площа основи поршня. Якщо газ,
розширюючись, перемістить поршень на
відстань
![]() ,
то він виконає елементарну роботу
,
то він виконає елементарну роботу
![]() або
або
![]() .
Але
.
Але
![]() – елементарний приріст об’єму газу,
тому остаточно
– елементарний приріст об’єму газу,
тому остаточно
Рис.2.6![]()

Роботу
скінченного приросту об’єму газу від
![]() до
до
![]() знаходимо як суму елементарних робіт
знаходимо як суму елементарних робіт
 .
(2.26)
.
(2.26)
У
випадку стискання газу напрямки сили
![]() та переміщення поршня протилежні і
та переміщення поршня протилежні і
![]() ,
,
![]() .
Приріст об’єму тепер теж від’ємний.
Таким чином, вирази (2.25) та (2.26) годяться
і у випадку стискання газу.
.
Приріст об’єму тепер теж від’ємний.
Таким чином, вирази (2.25) та (2.26) годяться
і у випадку стискання газу.
З
Рис.2.7
Застосуємо тепер вираз (2.26) до ізопроцесів. У випадку ізохорного процесу А=0, бо dV=0. При ізобарному процесі dp=0 і тиск можна винести з-під знаку інтегралу. Тоді маємо
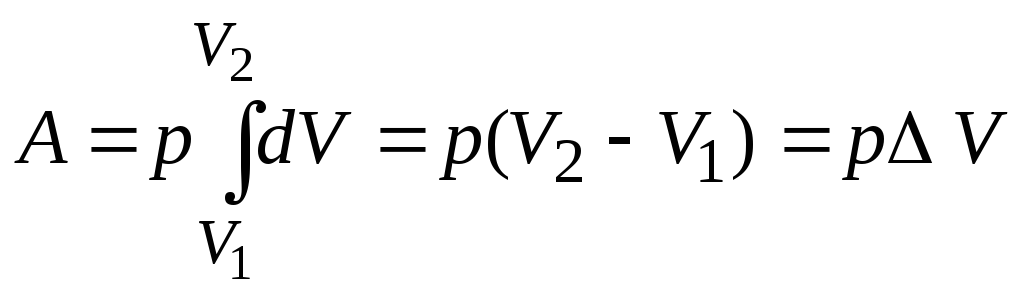 .
.
Якщо
використати рівняння Менделєєва-Клапейрона
![]() ,
то маємо
,
то маємо
![]() .
Тоді робота ізобаричного розширення
1-го моля ідеального газу матиме вигляд
.
Тоді робота ізобаричного розширення
1-го моля ідеального газу матиме вигляд
![]() .
Звідси
.
Звідси
![]() .
.
На основі останньої формули маємо фізичний зміст універсальної газової сталої: універсальна газова стала рівна роботі ізобаричного розширення одного моля ідеального газу при нагріванні його на один кельвін.
У
випадку ізотермічного процесу dT=0.
Тиск у формулу (2.26) підставимо з рівняння
Менделєєва-Клапейрона
![]() і, винісши сталі величини, виконаємо
інтегрування:
і, винісши сталі величини, виконаємо
інтегрування:
 .
.
Остаточно
![]() .
(2.27)
.
(2.27)
Вираз
(2.27) можна записати через відношення
тисків, якщо скористатися законом
Бойля-Маріота
![]() :
:
![]() .
.
§ 2.9. Перше начало термодинаміки та його застосування до ізопроцесів
В
термодинаміці розглядають тільки такі
системи, для яких механічна енергія
системи як цілого не змінюється. За
рахунок виконаної над системою роботи
![]() та переданої їй кількості теплоти
та переданої їй кількості теплоти
![]() змінюється лише внутрішня енергія
термодинамічної системи
змінюється лише внутрішня енергія
термодинамічної системи
![]() :
:
![]() .
(2.28)
.
(2.28)
Тут
![]() – приріст внутрішньої енергії (
– приріст внутрішньої енергії (![]() та
та
![]() – початкове та кінцеве значення
внутрішньої енергії). Співвідношення
(2.28) відображає закон збереження і
перетворення енергії стосовно теплових
процесів.
– початкове та кінцеве значення
внутрішньої енергії). Співвідношення
(2.28) відображає закон збереження і
перетворення енергії стосовно теплових
процесів.
На
відміну від механіки, де частіше
приходилося обчислювати роботу зовнішніх
сил, в термодинаміці, в основному, мають
справу з роботою системи проти зовнішніх
сил (А). Саме у зв’язку з цим ці величини
тут перепозначені. Перейдемо тепер у
рівнянні (2.28) від
![]() до
до
![]() (
(![]() на основі третього закону Ньютона) і
розв’яжемо одержане рівняння відносно
Q:
на основі третього закону Ньютона) і
розв’яжемо одержане рівняння відносно
Q:
![]() (2.29)
(2.29)
або в диференціальній формі
![]() .
(2.30)
.
(2.30)
![]() – елементарна
кількість теплоти, так само як
– елементарна
кількість теплоти, так само як
![]() – елементарна робота;
– елементарна робота;
![]() – елементарний приріст внутрішньої
енергії.
– елементарний приріст внутрішньої
енергії.
Співвідношення (2.29) (чи (2.30)) є математичним виразом першого начала (закону, принципу) термодинаміки. Формулювання цього принципу: кількість теплоти, наданої системі ззовні, витрачається на роботу системи проти зовнішніх сил і на збільшення внутрішньої енергії системи.
Не
треба думати, що завжди за рахунок
одержаного тепла внутрішня енергія
системи збільшується. Може бути, що
![]() ;
при цьому на основі (2.29)
;
при цьому на основі (2.29)
![]() ,
тобто система виконує роботу як за
рахунок одержаного тепла, так і за
рахунок запасу внутрішньої енергії. Як
і робота А, так і кількість теплоти Q
є величина алгебраїчна: Q<0
означає, що система віддає тепло
зовнішньому середовищу (холодильнику),
а Q>0
означає, що система одержує тепло від
нагрівника. Як і у випадку роботи, для
кількості теплоти не можна писати
,
тобто система виконує роботу як за
рахунок одержаного тепла, так і за
рахунок запасу внутрішньої енергії. Як
і робота А, так і кількість теплоти Q
є величина алгебраїчна: Q<0
означає, що система віддає тепло
зовнішньому середовищу (холодильнику),
а Q>0
означає, що система одержує тепло від
нагрівника. Як і у випадку роботи, для
кількості теплоти не можна писати
![]() ,
бо останнє означало б, що значок варіації
,
бо останнє означало б, що значок варіації
![]() еквівалентний значку диференціала d,
тобто що Q
є функцією стану системи. Правильним є
запис
еквівалентний значку диференціала d,
тобто що Q
є функцією стану системи. Правильним є
запис
![]() (сума елементарних кількостей теплоти
рівна повній кількості теплоти). Тепер
є очевидним, що інтегральна форма запису
1-го принципу термодинаміки (2.29) одержується
з диференціальної (2.30), якщо останню
проінтегрувати для деякого процесу,
початок якого формально позначити “1”,
а кінець – “2”:
(сума елементарних кількостей теплоти
рівна повній кількості теплоти). Тепер
є очевидним, що інтегральна форма запису
1-го принципу термодинаміки (2.29) одержується
з диференціальної (2.30), якщо останню
проінтегрувати для деякого процесу,
початок якого формально позначити “1”,
а кінець – “2”:
![]() .
.
Якісне формулювання 1-го принципу термодинаміки: неможливо побудувати періодично діючий двигун, який виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний двигун І-го роду неможливий).
Тепловий
двигун, про який іде мова в якісному
формулюванні принципу, це пристрій, що
перетворює внутрішню енергію в механічну
(“теплоту в роботу”). Основні частини
такої установки – робоче тіло (газ,
пара), нагрівник і холодильник. Періодично
діючий двигун такий, що внаслідок процесу
робоче тіло повертається за період до
вихідного (початкового) стану; тоді
![]() і
і
![]() на основі (2.29).
на основі (2.29).
Застосуємо
тепер 1-й принцип термодинаміки до
ізопроцесів в ідеальному газі. Оскільки
для ізохорного процесу
![]() ,
то з рівняння (2.29) маємо, що
,
то з рівняння (2.29) маємо, що
![]() .
Значить, при ізохорному процесі кількість
теплоти, одержана газом ззовні, йде на
збільшення внутрішньої енергії газу.
При цьому температура газу підвищується
(в наступному параграфі буде показано,
що внутрішня енергія ідеального газу
прямопропорційна абсолютній температурі).
.
Значить, при ізохорному процесі кількість
теплоти, одержана газом ззовні, йде на
збільшення внутрішньої енергії газу.
При цьому температура газу підвищується
(в наступному параграфі буде показано,
що внутрішня енергія ідеального газу
прямопропорційна абсолютній температурі).
У
випадку ізобаричного розширення
ідеального газу
![]() (див. попередній параграф); оскільки
(див. попередній параграф); оскільки
![]() теж додатнє, бо
теж додатнє, бо
![]() ,
то на основі (2.29)
,
то на основі (2.29)
![]() .
Температура газу зростає. 1-й принцип
термодинаміки для ізобаричного процесу
формулюється як у загальному випадку.
.
Температура газу зростає. 1-й принцип
термодинаміки для ізобаричного процесу
формулюється як у загальному випадку.
Для
ізотермічного процесу робота газу
розраховується за формулою (2.27). Оскільки
![]() ,
то
,
то
![]() і вираз 1-го принципу (2.29) зводиться до
наступного:
і вираз 1-го принципу (2.29) зводиться до
наступного:
![]() .
Це означає, що при ізотермічному процесі
кількість теплоти, одержана газом
ззовні, йде на роботу газу проти зовнішніх
сил.
.
Це означає, що при ізотермічному процесі
кількість теплоти, одержана газом
ззовні, йде на роботу газу проти зовнішніх
сил.
