
- •Прощекальников д.В Лабораторные занятия к дисциплине «Источники энергии теплотехнологии»
- •Лабораторная работа №1
- •Исходные данные и пример расчета
- •1) Материальный баланс.
- •Лабораторная работа 2
- •1. Элементный состав топлива
- •2. Теоретический расчет температур горения
- •3. Описание программы Программа требует введения исходных данных по элементному составу топлива, который можно взять из таблицы 1.
- •В программе предусмотрено использование температурной зависимости теплоемкостей продуктов сгорания и элементарных веществ согласно таблице 2.
- •Контрольные задания
- •1) Построить зависимость температуры горения от процентного содержания углерода, водорода, азота и коэффициента избытка воздуха
- •Контрольные вопросы
- •Лабораторная работа 3
- •1. Механизмы химических реакций термического разложения.
- •2 Параметры, влияющие на процесс пиролиза.
- •2.1 Влияние давления
- •2.2 Влияние инертного газа
- •2.3 Влияние концентрации
- •2.4 Влияние температуры
- •3. Описание установки и порядок проведения опытов
- •3.1 Анализ состава пирогаза
- •3.2 Анализ на со2
- •3.3 Расчетная часть
- •4 Пример расчета пиролиза лигроина
- •4.1 Обработка экспериментальных данных
- •4.2 Газовый анализ
- •4.3 Динамика пиролиза
- •4.3 Составление материального баланса и характеристик пиролиза
- •Лабораторная работа №4 Отбор экстра пара в выпарной установке
- •Контрольные вопросы
1. Механизмы химических реакций термического разложения.
При пиролизе протекают 2 группы сложных обратимых реакций: первичные, проходящие с увеличением объема и с образованием пирогаза и вторичные, проходящие с уплотнением и приводящие к смоло-коксообразованию
Первичные реакции
а) распад молекул предельных углеводородов с разрывом связи с-с (преимущественно в середине молекулы):

 СnН2n
+ 2
Сn’Н2n’
+ 2 + Cn’’Н2n’’
- Q
СnН2n
+ 2
Сn’Н2n’
+ 2 + Cn’’Н2n’’
- Q
б) дегидрирование предельных и нафтеновых углеводородов:

 СnН2n
+ 2 CnН2n
+ Н2
– Q
СnН2n
+ 2 CnН2n
+ Н2
– Q
СН2 СН2

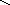


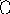

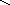

 СН2
СН2
СН2
СН2
СН2
СН2
СН2
СН2
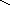



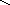
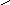 СН2
СН2
СН2
СН2
+ 3Н2 -
Q
СН2
СН2
СН2
СН2
+ 3Н2 -
Q
СН2 СН2
в) деалкилирование с отрывом боковой цепи:
СН СН

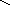

 СН
С - СН3
СН
СН
СН
С - СН3
СН
СН






 2
2 + СН2
= СН2
– Q
2
2 + СН2
= СН2
– Q
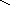

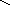
 СН
СН
СН
СН
СН
СН
СН
СН
СН СН
Гомоядерная ароматика (бензол, нафталин и пр.) не подвергается распаду.
Вторичные реакции
а) изомеризация предельных углеводородов:

 Н
– СnН2n+2
изо
– СnН2n+2
+ Q
Н
– СnН2n+2
изо
– СnН2n+2
+ Q
б) полимеризация:

 nС2Н4
(С2Н4)n
+ Q
nС2Н4
(С2Н4)n
+ Q
в) циклизация:
 СН2
СН2
 СН2
= СН (СН2)3СН3
CН2
СН2
+ Q
СН2
= СН (СН2)3СН3
CН2
СН2
+ Q
 СН2
СН2
СН2
СН2
СН2
г) дегидрирование олефинов с образованием диолефинов:

 СН2
= СН – СН2
– СН3
СН2
= СН – СН = СН2
+ Н2
+ Q
СН2
= СН – СН2
– СН3
СН2
= СН – СН = СН2
+ Н2
+ Q
д) конденсация диолефинов с олефинами:
СН2 СН


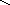





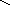 СН
СН2
СН
СН
СН
СН2
СН
СН
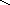

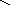


 +
2Н2 + Q
+
2Н2 + Q
СН СН2 СН СН
СН2 СН
Таким образом, продуктами пиролиза являются газообразные, жидкие и твердые углеводороды (пирогаз, смолы, кокс).
Итак, основная реакция пиролиза (особенно в случае использования в качестве сырья нефтяных фракций) - крекинг углеводородной цепи с образованием олефина и парафина. Ее первичные продукты могут претерпевать дальнейшее расщепление. В конечном итоге получается смесь легких углеводородов, богатая олефинами. Дегидрирование соответствующих олефинов приводит к образованию ацетилена и его производных, а также бутадиена и других диеновых углеводородов, обладающих высокой реакционной способностью. Последние в условиях пиролиза вступают в реакции циклизации или Дильса-Альдера. При дегидрировании из циклоолефинов получаются арены, в частности бензол, являющиеся, в свою очередь, предшественниками полициклических углеводородов и кокса. Протеканию последних реакций (значит, и увеличению отложения кокса) благоприятствует повышение температуры до 900-1400°С
Другой нежелательный процесс - полимеризация ненасыщенных углеводородов в условиях пиролиза практически не протекает. Это реакция экзотермична и начи-нается лишь при понижении температуры. Быстрое преодоление температурной области, где она уже возможна, и скорость ее еще высока - основная задача стадии охлаждения газов пиролиза [6].
